
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系
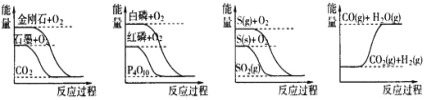
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应
B. 白磷比红磷稳定
C. ①S(g)+O2(g)=SO2(g);②S(s)+O2(g)=SO2(g);放出热量:①②
D. CO(g)+H2O(g)=CO2(g)+ H2 (g);该反应为吸热反应
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】(1)结合表中给出的电离平衡常数回答下列问题:
酸或碱 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、_______(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体
D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式___________________________________。
(2) 某学习小组利用酸性KMnO4和H2C2O4反应来探究“外界条件对化学反应速率的影响”。 实验时,先分别量取KMnO4酸性溶液、H2C2O4溶液,然后倒入大试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
①已知草酸H2C2O4是一种二元弱酸,写出草酸的电离方程式__________、___________。酸性KMnO4溶液和H2C2O4溶液反应的离子方程式为:_____________________________
某同学设计了如下实验
实验编号 | H2C2O4溶液 | KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||
a | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
b | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
c | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
②探究浓度对化学反应速率影响的组合实验编号是__________,可探究温度对化学反应速率影响的实验编号是__________。
③实验a测得混合后溶液褪色的时间为40 s,忽略混合前后体积的微小变化,则这段时间内的平均反应速率v(KMnO4)=______ mol·L-1·min-1。
④在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快,其可能的原因是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
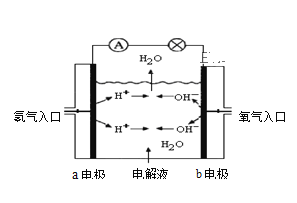
(1)下列叙述不正确的是 ______ 。
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极 _________,b极 ____________;
(3)若电解质溶液为稀H2SO4,则电极反应式为:a极 __________,b极____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
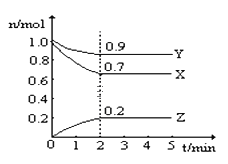
(1)该反应的化学方程式为 _______________________。
(2)从开始至2min,Z的平均反应速率为 ___________。
(3)某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究 ______ 、 ______ 对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明 ________________________________ ,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______;
④请设计一个实验方案证明盐酸的浓度对该反应的速率的影响: ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是现行中学化学教科书中元素周期表的一部分,除标出的元素外。表中的每个编号表示一种元素,请根据要求回答问题:
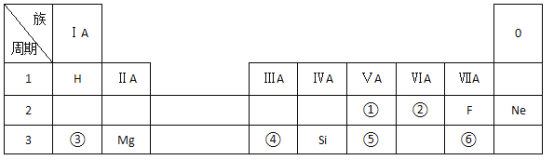
(1)②表示的元素是____________(填元素符号)。
(2)①与⑤两种元素相比较,原子半径较大的是 ______(填元素符号);其非金属性较强的是 ______(填元素符号);其最高正价氧化物水化物酸性较强的酸是_____(填分子式)。
(3)⑥元素的单质可以用来制取漂白粉,其有效成分是______(填化学式)。
③与⑥两种元素所形成化合物的电子式是____________。
(4)写出元素③的最高价氧化物对应的水化物与元素④的最高价氧化物对应的水化物相互反应的化学方程式________________________。
(5)②与⑥元素的氢化物的稳定性 ______大于______(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择性催化还原法(SCR)烟气脱硝技术是一种成熟的NOx控制处理方法,主要反应如下:
①4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H1=akJ·mol-1
4N2(g)+6H2O(g) △H1=akJ·mol-1
②4NH3(g)+2NO2(g)+O2(g)![]() 3N2(g)+6H2O(g) △H2=bkJ·mol-1
3N2(g)+6H2O(g) △H2=bkJ·mol-1
副反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H4=dkJ·mol-1
4NO(g)+6H2O(g) △H4=dkJ·mol-1
可以计算出反应2NO(g)+O2(g)![]() 2NO2(g)的△H为( )
2NO2(g)的△H为( )
A. (4b-3a+d)/4 B. (4a-3b+d)/4 C. (3b-4a+d)/4 D. (3a-4b+d)/4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积的密闭容器中,可逆反应: mA(气)+nB(气) ![]() pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化, ②体系的密度不再发生变化, ③各组分的物质的量浓度不再改变, ④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是
pC(气)+qD(气),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化, ②体系的密度不再发生变化, ③各组分的物质的量浓度不再改变, ④各组分的质量分数不再改变,⑤反应速率vA:vB:vC:vD=m:n:p:q,其中,能说明反应已达到平衡的是
A. ③④ B. ②③④ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com