
| A. | H2S2O3溶液显弱酸性的原因是:H2S2O3?H++HS2O3- | |
| B. | Na2S2O3溶液显碱性的原因是:S2O32-+2 H2O?H2S2O3+2OH- | |
| C. | Na2S2O3和AgBr反应的离子方程式是:2S2O32-+AgBr?Ag(S2O3)23-+Br- | |
| D. | 定影不能在酸性较强的溶液中进行的原因是:S2O32-+2H+=S↓+SO2↑+H2O |
分析 A.H2S2O3是弱酸,在溶液中部分电离;
B.Na2S2O3属于强碱弱酸盐,在溶液中水解显碱性,多元弱酸盐分步水解;
C.根据题中信息可知,Na2S2O3和AgBr反应生成Ag(S2O3)23-;
D.在酸性条件下,S2O32-和H+能发生氧化还原反应反应.
解答 解:A.H2S2O3是弱酸,在溶液中部分电离,其电离方程式为:H2S2O3?H++HS2O3-,故A正确;
B.Na2S2O3属于强碱弱酸盐,在溶液中水解显碱性,多元弱酸盐分步水解,其水解方程式为:S2O32-+H2O?HS2O3-+OH-,故B错误;
C.根据题中信息可知,Na2S2O3和AgBr反应生成Ag(S2O3)23-,则反应离子方程式为:2S2O32-+AgBr?Ag(S2O3)23-+Br-,故C正确;
D.在酸性条件下,S2O32-和H+能发生氧化还原反应反应,其反应的离子方程式为:S2O32-+2H+=S↓+SO2↑+H2O,所以定影不能在酸性较强的溶液中进行,故D正确.
故选B.
点评 本题考查了弱酸的电离、盐的水解、离子方程式、氧化还原反应等,题目难度中等,注意把握题目所给的信息,侧重于考查学生的分析能力和应用知识解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 氧化钠与盐酸:O2-+2H+═H2O | |
| C. | 碳酸氢钠溶液与稀硫酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 烧碱溶液与碳酸氢钠溶液:HCO3-+OH-═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
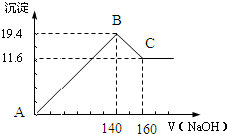
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管和锥形瓶在使用前要用润洗 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| D. | 将CO2和SO2混合气体分别通入BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸盐都易溶于水 | |
| B. | 检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品-→粉碎-→加水溶解-→过滤-→向滤液中滴加KSCN溶液 | |
| C. | 分别还原a mol Fe2O3所需H2、Al、CO物质的量之比为3:2:3 | |
| D. | 明矾含有结晶水,是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2g | |
| B. | 用25mL碱式滴定管量取高锰酸钾溶液,体积为16.60mL | |
| C. | 用干燥的广泛pH试纸测稀盐酸的pH=3.2 | |
| D. | 用10mL量筒量取NaCl溶液,体积为9.2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的变化过程,上述两个反应属于水解反应 | |
| B. | 丹参素结构如图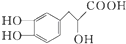 所示,能发生取代、加成、氧化反应 所示,能发生取代、加成、氧化反应 | |
| C. | 乙烯含双键,可使酸性KMnO4溶液褪色,而乙醇中只含单键不能使酸性高锰酸钾溶液褪色 | |
| D. | 回收地沟油,水解制氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
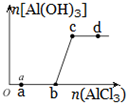 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系示意如图所示.则的下列说法不正确的是( )| A. | a点对应的溶液中加入MgCl2无明显现象 | |
| B. | b点对应的溶液是NaAlO2溶液 | |
| C. | c点对应的溶液中c(Na+)=c(Cl-) | |
| D. | d点对应的溶液呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com