
【题目】H2X为二元弱酸,常温下,将NaOH溶液加入到H2X溶液中,在不同pH环境下,不同形态的粒子(酸、酸式酸根、酸根离子)的组成分数如图所示。下列说法正确的是

A. HX-的电离程度小于水解程度
B. 在pH=7的溶液中HX-和X2-能大量共存
C. 在pH=9时,H2X 与NaOH恰好完全中和
D. 1L.0.1 molL-1Na2X溶液中,n(HX-)+2n(X2-)+n(H2X)=0.1 mol
科目:高中化学 来源: 题型:
【题目】室温下,把下列各题的结果填在横线上。
(1)c(OH-)=1×10-3mol/L的溶液的pH=___________________
(2)0.01mol/L HNO3溶液中,水电离出的H+的物质的量的浓度c(H+)=_________________
(3)某溶液由水电离出H+的物质的量的浓度c(H+)= 1×10-5mol/L,则该溶液可以是______(填“硫酸”或“氯化铵”或 “氢氧化钠” 或“氯化钠”)溶液
(4)将0.39g过氧化钠溶于足量水中并配成100 mL溶液,则溶液的pH=_____________
(5)0. 12mol/L HCl溶液与0.1mol/L 的NaOH溶液等体积混合,混合液的pH=___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1molL﹣1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:

下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3H2O)>Ka1(H2CO3)
B. 0.1 molL-1 NH4HCO3溶液中存在:c(NH3H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室在 500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示 (已知分解的固体产物可能有 FeO、Fe2O3 和 Fe3O4,气体产物可能有 NH3、N2、H2O、SO3 和 SO2)。下列说法正 确的是( )
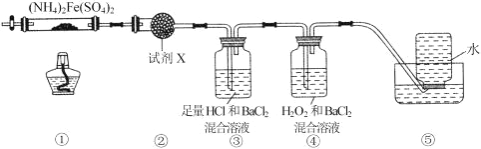
A. 取①中固体残留物与稀硫酸反应并滴加 KSCN,溶液变红,则残留物一定为 Fe2O3
B. 装置②用于检验分解产物中是否有水蒸气生成,试剂 X 最好选用碱石灰
C. 装置③用于检验分解产物中是否有 SO3 气体生成并除去 SO3 和 NH3
D. 装置④用于检验分解产物中是否有 SO2 气体生成,装置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
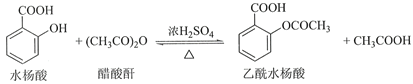
水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~-74 | 135~138 |
相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的_______________________(填名称)。
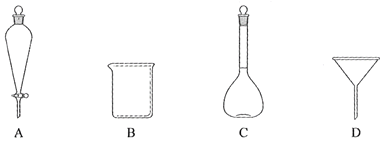
(3)①中需使用冷水,目的是______________________________________。
(4)②中饱和碳酸氢钠的作用是_________________________________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为____________。
(6)本实验的产率是_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
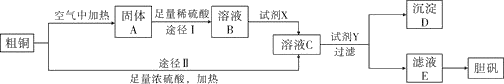
【题目】胆矾![]() 是一种重要的含铜化合物,某课外研究小组用粗铜(含少量
是一种重要的含铜化合物,某课外研究小组用粗铜(含少量![]() )通过不同的化学反应制取胆矾的过程如图:
)通过不同的化学反应制取胆矾的过程如图:
物质 | 完全沉淀时的pH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
当溶液中被沉淀离子的物质的量浓度小于![]() 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
试回答下列问题:
(1)下列物质中,最适合作为试剂X的是________(填序号)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)由粗铜通过两种途径制取胆矾,与途径Ⅱ相比,途径Ⅰ有明显的两个优点,分别是______________、____________________。
(3)试剂Y可以是______________________(任填一种物质的化学式)。
(4)若溶液C中![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() ,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
,则向溶液C中加入少量试剂Y的过程中应控制溶液C的pH范围约为________。
(5)氢化亚铜![]() 是一种红色固体,40~50℃时,滤液E和
是一种红色固体,40~50℃时,滤液E和![]() 溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5
溶液混合反应可得氢化亚铜沉淀,同时得到硫酸和磷酸,该反应的离子方程式为___________________________________,该反应每转移1.5![]() 个电子,生成CuH的物质的量为________mol。
个电子,生成CuH的物质的量为________mol。
(/span>6)纳米氧化亚铜![]() 是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成
是一种用途广泛的光电材料,电化学法可用铜棒和石墨作电极,电解滤液E获得纳米氧化亚铜,电解过程中无气体产生,则铜棒作________极,生成![]() 的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
的电极反应式为______________________,电解过程中滤液E的浓度____________(填“增大”“不变”或“减小”)。
(7)得到![]() 晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
晶体,乙醇代替蒸馏水洗涤晶体的目的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:CH4(g) + H2O(g)=CO(g) +3H2(g) △H=+206.2 kJ/mol
CH4(g) + CO2(g)=2CO(g) +2H2(g) △H=+247.4 kJ/mol
2H2S(g)=2H2(g) +S2(g) △H=+169.8 kJ/mol
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________。
(2)①H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是_________________________________。
②燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式________________________________。
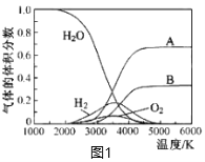
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图中A、B表示的物质依次是_________________。
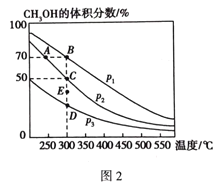
(4)将1 molCO和2 molH2充入恒容密闭容器中,在催化剂作用下发生如下反应:CO(g) + 2H2(g)![]() CH3OH(g),不同压强下CH3OH在平衡混合气体中的体积分数随温度的变化如图2所示。A、B、C三点的化学平衡常数K(A)、K(B)、K(C)的相对大小为_______________,计算C点的压强平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
CH3OH(g),不同压强下CH3OH在平衡混合气体中的体积分数随温度的变化如图2所示。A、B、C三点的化学平衡常数K(A)、K(B)、K(C)的相对大小为_______________,计算C点的压强平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法不正确的是
A. 1mol O2与金属钠反应,O2不一定得到4NA个电子
B. 标准状况下,a L CH4和a L C6H14中所含分子数均为![]()
C. 常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子
D. 在20℃、1atm时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,W 在大气中有两种同素异形体且均能支持燃烧,X 单质能在 Z2 气体中燃烧,发出黄色火焰,Y 在同周期非金属元素中原子半径最大。下列叙述正确的是
A.Y 单质的熔点低于 X 单质
B.Z 的含氧酸均为弱酸
C.Y、Z 的单质都能在 W2 气体中燃烧
D. 中 W 和 Y 都满足 8 电子稳定结构
中 W 和 Y 都满足 8 电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com