

分析 (1)P的核外电子排布式为1s22s22p63s23p3,则其价电子排布式为3s23p3,同周期主族元素从左至右,第一电离能呈增大的趋势,其中第VA族反常,第一电离能大于相邻主族元素;
(2)①P4分子为正四面体构型,P4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,据此解答;
②根据黑磷是一种有金属光泽的晶体,能够导电,联想到石墨晶体的结构,二者具有相似性,也是层状结构,据此解释;
(3)磷的含氧酸中,酸性顺序为:H3PO2>H3PO3>H3PO4;
(4)同主族元素从上到下电负性逐渐减小,同周期主族元素从左至右,电负性逐渐增大;
(5)①磷化硼(BP)是一种半导体材料,熔点为1000℃,熔点很高,且二者都是非金属元素,应为原子晶体;
②已知A,B的原子坐标分别为(0,0,0),(1,$\frac{1}{2}$,$\frac{1}{2}$),不妨以A为晶胞坐标原点,根据立体几何知识写出C的原子坐标;
③根据晶体密度公式$ρ=\frac{z{M}_{r}}{{N}_{A}V}$计算,其中z为一个晶胞的粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积.
解答 解:(1)P的核外电子排布式为1s22s22p63s23p3,则其价电子排布式为3s23p3,同周期主族元素从左至右,第一电离能呈增大的趋势,其中第VA族反常,第一电离能大于相邻主族元素,则第一电离能磷>硫,
故答案为:3s23p3;>;
(2)①根据P4的分子构型,P4分子为正四面体构型,P4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,则白磷分子中磷原子的杂化轨道类型为sp3,含有孤电子对数目为4,
故答案为:sp3;4;
②黑磷是一种有金属光泽的晶体,能够导电,联想到石墨晶体的结构,二者具有相似性,也是层状结构,则
能够导电的原因是:黑鳞具有层状结构,层与层之间的键合比层内的键合弱,与石墨相似,故具有导电性,
故答案为:黑鳞具有层状结构,层与层之间的键合比层内的键合弱,与石墨相似,故具有导电性;
(3)磷的含氧酸中,酸性顺序为:H3PO2>H3PO3>H3PO4,因此酸性H3PO4<H3PO3,
故答案为:<;
(4)同主族元素从上到下电负性逐渐减小,同周期主族元素从左至右,电负性逐渐增大,P和As同主族,电负性P>As,Ga和As同周期,电负性Ga<As,综上,电负性大小顺序为P>As>Ga,
故答案为:P>As>Ga;
(5)①磷化硼(BP)是一种半导体材料,熔点为1000℃,熔点很高,且二者都是非金属元素,应为原子晶体,
故答案为:原子;
②已知A,B的原子坐标分别为(0,0,0),(1,$\frac{1}{2}$,$\frac{1}{2}$),不妨以A为晶胞坐标原点,联想到金刚石晶胞的相似性,C与周围与之相连的四个原子形成一个正四面体,根据立体几何知识,不难求出C的原子坐标为($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$),
故答案为:($\frac{3}{4}$,$\frac{3}{4}$,$\frac{3}{4}$);
③取1mol晶胞,则含有NA个晶胞,对于立方晶胞,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,晶胞内部粒子为整个晶胞所有,则一个晶胞中,含有B的个数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,含有P的个数为4,因此,1mol晶胞的质量为m=(4×42)g,一个晶胞的体积为V0=a3pm3=(4.78×10-8)3cm3,因此晶体的密度为$ρ=\frac{m}{{N}_{A}{V}_{0}}$=$\frac{42×4}{{N}_{A}•(4.78×1{0}^{-8})^{3}}$g/cm3,
故答案为:$\frac{42×4}{{N}_{A}•(4.78×1{0}^{-8})^{3}}$.
点评 本题考查物质结构知识,包含核外电子排布式,第一电离能和电负性的比较,晶胞的知识等,涉及的知识点较多,具有一定的综合性.本题难度中等,是中档题.
值得一提的是,本题的(3)中无机含氧酸的比较并不符合通常的高价态酸酸性强,或者是Pauling规则,磷的含氧酸强度刚好相反,至于原因,可以用离子极化理论解释,无机含氧酸中,存在P对-OH的极化,还存在-OH上的H+对O的反极化,次磷酸H3PO2和亚磷酸H3PO3中,前者是有2个H直接连着P,后者是1个H连着P,而磷酸H3PO4,没有H直接相连P(与P直接相连的H原子不电离,-OH上的H会电离!),由于H的原子体积小,可以钻入P的电子云中,增强P对-OH的极化,从而削弱H+对O的反极化,使得-OH上的H+更易电离,显然与P直接相连的H原子数目越多,H+越容易电离,酸性越强,就造成了酸性H3PO2>H3PO3>H3PO4这一反常现象.当然还可以从热力学角度解释,到了大学探究.记住这一结论就行.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
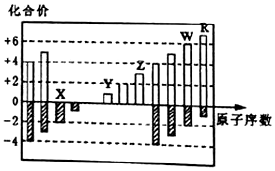
| A. | 原子半径:R>W>Z>Y>X | |
| B. | 氧化物对应水化物的酸性:R>W | |
| C. | 气态氢化物的稳定性:W>X | |
| D. | Y、Z、W最高价氧化物对应水化物两两之间均能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol NH 5 中含有5N A 个NH键(N A 表示阿伏加德罗常数) | |
| B. | NH 5 中既有共价键又有离子键,它形成的晶体是离子晶体 | |
| C. | NH 5的电子式为: | |
| D. | 它与水反应的化学方程式为:NH 5+H 2O═NH 3H 2O+H 2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与氯化铁溶液反应:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 锌粒与稀硝酸反应:Zn+2 H+═Zn2++H2↑ | |
| C. | 氯气与水反应:H2O+Cl2═2H++Cl-+ClO- | |
| D. | 工业制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ 1s22s22p63s23p6 | B. | Cu+ 1s22s22p63s23p63d104s1 | ||
| C. | N3- 1s22s22p6 | D. | As 1s22s22p63s23p63d104s24p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| B. | 碳酸钡与稀硫酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | CuSO4溶液与少量稀氨水反应:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 铁和氯化铁溶液反应:2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
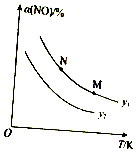 NO、NO2 和CO均为大气污染物,对其治理备受关注.请回答下列问题:
NO、NO2 和CO均为大气污染物,对其治理备受关注.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com