
已知反应:![]() ,能进行完全。以下推论中正确的是
,能进行完全。以下推论中正确的是
A.BeCl2溶液的pH<7。将其蒸干,灼烧后可得残留物Be(OH)2
B.![]() 溶液的pH>7,将其蒸干,灼烧后可得残留物BeO
溶液的pH>7,将其蒸干,灼烧后可得残留物BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,BeCl2一定是离子化合物.
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |

- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 )与二苯酮反应制备三苯甲醇.
)与二苯酮反应制备三苯甲醇.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
- 3 |
- 3 |
| ||
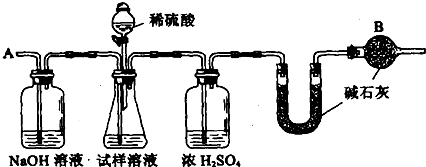
| 106(d-b) |
| 44a |
| 106(d-b) |
| 44a |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
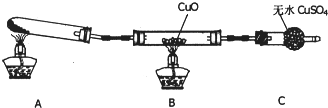
| H+ |
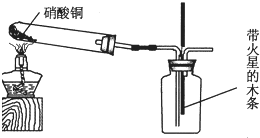
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验变量 实验序号 |
银氨溶液 /mL |
乙醛的量 /滴 |
水液温度/℃ | 反应混合液的PH | 出现银镜时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
| 银氨溶液 | 加(NH4)2S ① |
过滤、洗涤 ② |
烘干 ③ |
Ag2S沉淀 | 铁粉还原 ④ |
银 粉 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com