
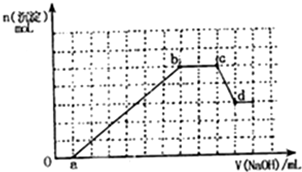
 某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.
某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.分析 加入NaOH溶液后,在0-a段没有生成沉淀,说明溶液中一定存在H+或HCO3-离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在Al3+,由于HCO3-和Al3+会发生双水解而不能共存,则只能存在H+;a-b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,根据c-d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,另一种离子为Mg2+,无色溶液中一定不含铁离子,b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+.
解答 解:加入NaOH溶液后,在0-a段没有生成沉淀,说明溶液中一定存在H+或HCO3-离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在Al3+,由于HCO3-和Al3+会发生双水解而不能共存,则只能存在H+;a-b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Al3+,
根据c-d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,另一种离子为Mg2+;
b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+.所以溶液中一定含有n(H+)、n(Al3+)、n(NH4+),n(SO42-).
(1)ab段生成沉淀是的离子方程式为:Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓;故答案为:Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓;
(2)根据c-d段部分沉淀溶解,可知一定存在铝离子,是氢氧化铝溶于氢氧化钠中的一段,发生的反应为:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(3)b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+,故答案为:加入的NaOH与原溶液中NH4+反应生成NH3•H2O;
(4)原溶液中含有的阳离子是H+、NH4+、Al3+,一定不存在镁离子,根据消耗的氢氧化钠的物质的量可以认为n(H+)=a,n(Al3+)=a,n(Mg2+)=1.5a,
n(NH4+)=2a,根据电荷守恒,n(SO42-)=4.5a,n(H+):n(Al3+):n(NH4+):n(SO42-):n(Mg2+)=2:2:4:9:3,
故答案为:n(H+):n(Al3+):n(NH4+):n(SO42-):n(Mg2+)=2:2:4:9:3.
点评 本题考查了离子检验的方法应用,题目难度中等,氢氧化铝是两性氢氧化物溶于强碱是解题关键,本题难点在于如何根据图象中的数据判断铁离子的存在及根据溶液电中性判断一定存在硫酸根离子.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 燃着的酒精灯不慎碰到失火,应立即用湿布盖灭 | |
| B. | 酸碱中和滴定实验中,滴定管和锥形瓶都要用待装溶液润洗 | |
| C. | 用浓氨水洗涤做过银镜反应的试管 | |
| D. | 测某溶液的pH时,将pH试纸浸入待测溶液中,过一会儿取出,与标准比色卡进行对比 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C2H4和C2H20一定互为同系物 | |
| B. | 丙氨酸和苯丙氨酸脱水缩合,最多可生成3种二肽 | |
| C. | 葡萄糖在人体内被氧化,最终转化为二氧化碳和水,并释放能量 | |
| D. | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,有沉淀析出,再加水沉淀会溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| X | 元素最高正价与最低负价的绝对值相等 |
| Y | 是地壳中含量最多的元素 |
| Z | 元素基态原子3p能级只有一个电子 |
| W | 与Z位于同周期,能量最高的p 能级电子为半充满 |
| R | 单质为黄色固体,常存在于火山喷发口 |
| T | 元素基态原子核未成对电子最多 |
| 第一电离能 | 离子半径 | 离子还原性 | 最高价氧化物的熔点 |
| W>R | Y>Z | Y<R | X<Z |
 (或
(或 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
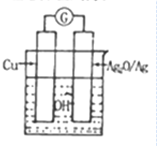 普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.
普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性.根据这一特点,科学家发明了电动势(E)法则水泥初凝时间,此法原理如图所示.反应总方程式为:2Cu+Ag2O═Cu2O+2Ag.| A. | 工业上制备水泥的原料有黏土、石灰石、石膏 | |
| B. | 测量原理装置图中Ag2O/Ag极发生还原反应 | |
| C. | 负极的电极反应式为2Cu+H2O-2e-=Cu2O+2H+ | |
| D. | 在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
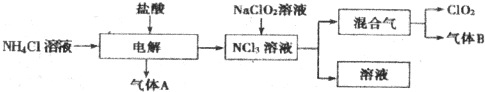
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
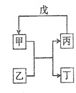 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | O2 | NO | H2O |
| B | Fe | H2O | H2 | Fe2O3 |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| D | Na2O2 | CO2 | O2 | Na |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com