
| △c |
| △t |
| c(N2O4) |
| c2(NO2) |
| △c |
| △t |
| (0.8-0.4)mol/L |
| 10min |
| c(N2O4) |
| c2(NO2) |
| 0.6 |
| 0.8×0.8 |


科目:高中化学 来源: 题型:
| ||
| ||
| 加热 |
| A、都是置换反应 |
| B、都是氧化还原反应 |
| C、反应中钛元素都被还原 |
| D、加热时金属钛和氩气(Ar)能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
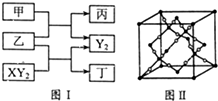 W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:
W、X、Y、Z是原子序数依次增大的短周期元素,它们中的两种或三种元素组成化合物甲、乙、丙、丁,几种物质的转化关系如图I所示.常温下0.01mol/L-1丙溶液pH=12;XY2分子是非极性分子,但科学家在特殊条件下制得了XY2的原子晶体,其晶胞结构如图Ⅱ所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:查看答案和解析>>
科目:高中化学 来源: 题型:
 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.查看答案和解析>>
科目:高中化学 来源: 题型:
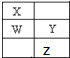 W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、常压下四种元素的单质中,X的非金属性最强 |
| B、四种元素都能与氧元素形成稳定的化合物 |
| C、Y、Z 离子最外层电子数相同 |
| D、Y元素具有两性元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com