
分析 以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq)平衡常数概念写出计算式,依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算分析.
解答 解:溶浸过程中会发生:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq),CaCO3(s)=Ca2++CO32-、CaSO4(s)=Ca2++SO42-,
依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同可知,反应CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq)的平衡常数为:K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{{K}_{sp}(CaS{O}_{4})}{{K}_{sp}(CaC{O}_{3})}$=$\frac{4.90×1{0}^{-5}}{2.80×1{0}^{-9}}$=1.75×104,
答:此温度下该反应的平衡常数为1.75×104.
点评 本题考查了难溶物溶解平衡及其应用,题目难度中等,明确难溶物溶解平衡的影响因素为解答关键,注意掌握溶度积的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
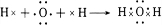 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
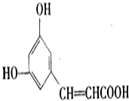
| A. | ①④ | B. | ②⑥ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
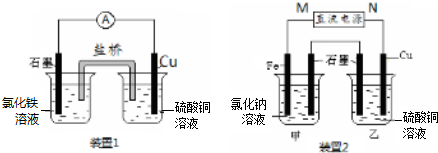
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
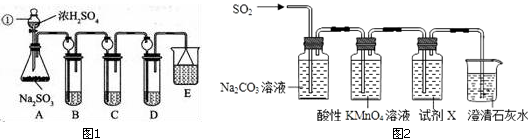
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 稀硫酸中滴加氢氧化钡溶液:H++OH-═H2O | |
| C. | 碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子数小于或等于10的烷烃中其一氯代物只有一种的烷烃有4种 | |
| B. | C8H10中只有三种属于芳香烃的同分异构体 | |
| C. | 结构简式为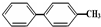 的烃,分子中含有两个苯环的该烃的同分异构体为4种 的烃,分子中含有两个苯环的该烃的同分异构体为4种 | |
| D. | 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
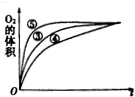 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分 组 实 验 | 催化剂 | |
| ① | 10mL 5%的H2O2溶液 | 无 |
| ② | 10mL 2%的H2O2溶液 | 无 |
| ③ | 10mL 5%的H2O2溶液 | 1mL 0.1mol/L的FeCl3溶液 |
| ④ | 10mL 5%的H2O2溶液+少量盐酸 | 1mL 0.1mol/L的FeCl3溶液 |
| ⑤ | 10mL 5%的H2O2溶液+少量NaOH溶液 | 1mL 0.1mol/L的FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com