
| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
分析 A.碱金属性质较活泼,都能和水反应生成碱及氢气;
B.碱金属只有钠的焰色反应呈现黄色.
C.Rb、Cs的密度大于1g/cm3;
D.只有Na在空气中燃烧生成过氧化钠.
解答 解:A.碱金属性质较活泼,都能和水反应生成碱及氢气,故A正确;
B.碱金属单质都是质软、电和热的良导体,但只有钠焰色反应呈现黄色,故B错误;
C.Li、Na、K的密度小于1g/cm3,Rb、Cs的密度大于1g/cm3,故C错误;
D.Li在空气中燃烧生成氧化锂,Na在空气中燃烧生成过氧化钠、K在空气中燃烧生成超氧化钾,故D错误;
故选A.
点评 本题考查了碱金属族元素性质,以碱金属族为代表掌握同一主族元素性质递变规律,知道规律中的异常现象,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用农作物秸秆制取乙醇 | |
| B. | 回收地沟油,制备生物柴油 | |
| C. | 焚烧废旧塑料,防止白色污染 | |
| D. | 开发利用各种新能源,减少对化石燃料的依赖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HDO与H2O化学性质不同 | |
| B. | 用漂粉精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更佳 | |
| C. | 工业上最理想的化学反应是原子利用率达到100%的反应 | |
| D. | 新原子的发现意味着新元素的合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的溴的四氯化碳溶液 | B. | 与足量的液溴反应 | ||
| C. | 点燃 | D. | 在一定条件下与氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
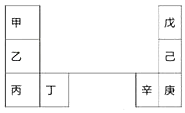 甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如表.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质.下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙和庚的原子核外电子数相差11 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
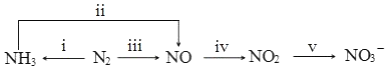
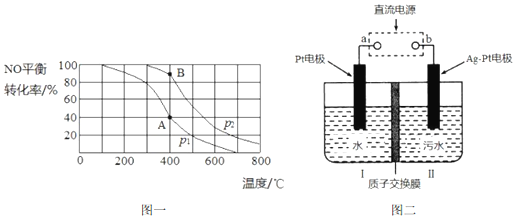
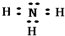 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
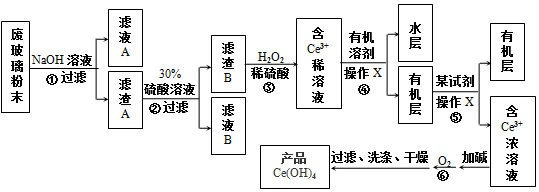
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
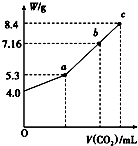 往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M,通入CO2的体积(标准状况)与M的质量W的关系如图所示.试回答下列问题:
往100mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M,通入CO2的体积(标准状况)与M的质量W的关系如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
| A. | 阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 | |
| B. | 相同条件下的酸性:H2CO3<HCN | |
| C. | 三种溶液中均存在电离平衡和水解平衡 | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 ol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com