
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 | |
| D. | 烧过菜的铁锅加入清水放置,出现红棕色的锈斑 |
分析 能构成原电池的可以用原电池原理解释,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,根据原电池构成条件来分析解答.
解答 解:A.锌、铁和海水符合原电池构成条件,能形成原电池,船壳上装一定数量的锌块可以减少船体的腐蚀,可以用原电池原理解释,故A不选;
B、红热的铁丝与冷水接触,不能构成原电池,表面形成蓝黑色保护层是因为金属铁和水蒸气反应生成四氧化三铁的缘故,所以不能用原电池原理解释,故B选;
C.锌和和硫酸铜反应生成铜,铜、锌和稀硫酸能构成原电池,所以可以用原电池原理解释,故C不选;
D、烧过菜的铁锅加入清水放置,金属铁、C、盐水构成原电池,加速金属铁的腐蚀,所以可以用原电池原理解释,故D不选;
故选B.
点评 本题考查了原电池原理,明确原电池构成条件是解本题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
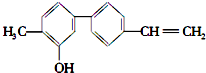
| A. | 由于含有氧元素不是有机物 | B. | 该物质的分子式是 C15H14O | ||
| C. | 分子中含有羟基属于醇 | D. | 分子中有三种官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为2NA | |
| C. | 92 g NO2和N2O4的混合气体中含有的原子总数为6NA | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
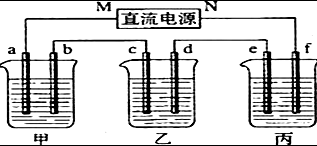 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素Q是短周期非金属性最强的元素 | |
| B. | Y、Z形成的化合物中只有一种属于酸性氧化物 | |
| C. | Y、Z、Q分别与W形成的化合物中,Z形成的化合物的沸点最高 | |
| D. | X分别与Y、Z、W形成的化合物中可能既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | CO2 | C. | HNO3 | D. | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1 mol/L Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在:c (Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol/L:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-) | |
| D. | 常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液的Kac(H+)值减小到原来的$\frac{1}{10}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com