
分析 (1)二氧化氮与水反应生成硝酸与NO;
根据转移电子及二氧化氮中N元素化合价变化计算二氧化氮物质的量,再根据V=nVm计算二氧化氮体积;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ•mol-1
根据盖斯定律,(①-②)÷2可得:NO2(g)+SO2(g)?SO3(g)+NO(g),反应热也进行相应计算;
(3)燃烧热是1mol物质完全燃烧生成稳定物质放出的热量,计算1mol乙烯燃烧放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(4)氢氧化钠均完全反应,硫酸为强酸,而醋酸为弱酸,电离吸收热量,反应放出的热量比硫酸反应放出的少;
(5)计算三氧化硫物质的量,根据热化学方程式计算放出的热量.
解答 解:(1)NO2与水反应生成硝酸和NO,反应的方程式为3NO2+H2O=2HNO3+NO;
反应6NO2+8NH3?7N2+12H2O中,NO2中N元素化合价降低,由+4价降低到0价,所以当转移1.2mol电子时,消耗NO2为$\frac{1.2mol}{4}$=0.3mol,体积为0.3mol×22.4L/mol=6.72L,
故答案为:3NO2+H2O=2HNO3+NO;6.72;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=-113.0kJ•mol-1
根据盖斯定律,(①-②)÷2可得:NO2(g)+SO2(g)?SO3(g)+NO(g),则
△H3=[-196.6kJ•mol-1 -(-113.0kJ•mol-1 )]=-41.8kJ/mol,
故答案为:-41.8;
(3)燃烧热是1mol物质完全燃烧生成稳定物质放出的热量,1mol乙烯燃烧放出的热量为560kJ×$\frac{1mol×28g/mol}{14g}$=1120kJ,乙烯燃烧热的热化学方程式为:C2H4(g)+3O2(g )=2CO2(g )+2H2O(l)△H=-1120KJ/mol,
故答案为:C2H4(g)+3O2(g )=2CO2(g )+2H2O(l)△H=-1120KJ/mol;
(4)氢氧化钠均完全反应,硫酸为强酸,而醋酸为弱酸,电离吸收热量,反应放出的热量比硫酸反应放出的少,故反应热:akJ•mol-1>bkJ•mol-1,
故答案为:>;
(5)平衡时,生成三氧化硫为2L×0.5mol/L=1mol,由2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,可知放出的热量为196.6kJ×$\frac{1mol}{2mol}$=98.3kJ,
故答案为:98.3kJ.
点评 本题考查反应热计算、盖斯定律应用、燃烧热、氧化还原反应计算等,(4)为易错点,注意反应热符号.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 用燃烧的方法鉴别真丝围巾和纯棉围巾 | |
| B. | 在烹调中加料酒和食醋,增加食物的香味 | |
| C. | 用工业酒精兑制饮用酒出售来提高利润 | |
| D. | 食用加碘盐,预防因缺碘引起的甲状腺肿大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
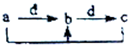 下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )
下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )| 物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | C | CO | CO2 | O2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 等浓度的碳酸钠溶液和硫酸钠溶液,前者碱性强,可以证明硫的非金属性比碳强 | |
| D. | 验证氧化性Fe3+<Br2<Cl2:向试管中依次加入1mL 0.1mol•L-1FBr2溶液、几滴KSCN 溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机相和水相中的现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中pH醋酸比盐酸大 | |
| B. | 与足量的锌粉反应产生的氢气体积相同 | |
| C. | 与足量锌粒反应时,一开始盐酸的速率快 | |
| D. | 能中和NaOH溶液的物质的量醋酸较少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
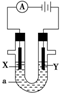 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 0.1 mol•L-1的甲酸溶液的pH约为2 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com