

分析 (1)根据反应原理CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4判断操作方法;
(2)工业上用氮气和氢气在高温 高压、催化剂条件下反应生成氨气,据此写出反应的化学方程式;
(3)煅烧碳酸钙后可生成CO2和CaO,其中CO2可循环使用;
(4)通常利用湿润的红色石蕊试纸检验NH3;
(5)“产品”为(NH4)2SO4,反应物为CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,据此写出反应的化学方程式.
解答 解:(1)该反应原理为:CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4,将沉淀池中的混合物经过滤可得到产品和沉淀,
故答案为:过滤;
(2)工业上用氮气和氢气在高温 高压、催化剂条件下反应生成氨气,反应的化学方程式为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,
故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3;
(3)CaCO3煅烧后可生成CO2和CaO,其中CO2可循环使用,
故答案为:CaO;CO2;
(4)利用湿润的红色石蕊试纸检验NH3,操作方法为:用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3,
故答案为:用湿润的红色石蕊试纸放在导气管口,若试纸变蓝,则证明有NH3;
(5)“产品”是(NH4)2SO4,反应物是CaSO4悬浊液、CO2、NH3等,产物除(NH4)2SO4外还有CaCO3,反应化学方程式为CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4,
故答案为:CaSO4+CO2+2NH3+H2O═CaCO3↓+(NH4)2SO4.
点评 本题考查了物质制备方法,题目难度中等,明确制备流程及发生反应原理为解答关键,注意掌握化学实验基本操作方法,试题侧重考查学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
| 物质 | 所加试剂(填化学式) | 离子方程式 |
| ①Mg(OH)2(Al(OH)3) | ||
| ②NaHCO3溶液(Na2CO3) | ||
| ③FeCl2溶液(FeCl3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
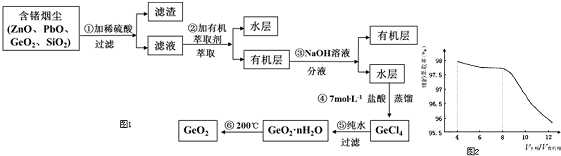
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
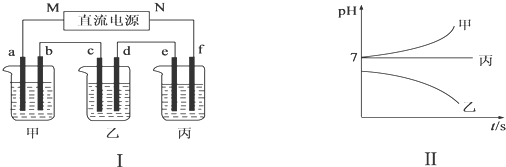
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 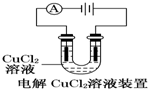 装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝 | |
| B. | 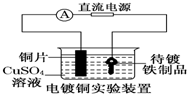 装置中待镀铁制品应与电源正极相连 | |
| C. |  装置中电子由b极流向a极 | |
| D. |  装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙 | |
| B. | 甲的气态氢化物的水溶液呈酸性 | |
| C. | 乙与丙形成的化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种气体被完全吸收,并生成BaSO4沉淀 | |
| B. | 两种气体被完全吸收,生成BaSO3和BaSO4沉淀 | |
| C. | 两种气体均不能被吸收,没有沉淀生成 | |
| D. | 只有一种气体被吸收,生成BaSO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
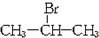 ,且烃A的结构简式为
,且烃A的结构简式为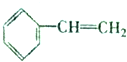 ,其在不同条件下能发生下图所示的一系列变化.
,其在不同条件下能发生下图所示的一系列变化.
 ,D
,D ,E
,E ,H
,H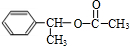 .
. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr. +2Br2→
+2Br2→ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com