
| 选项 | 实验操作 | 实验目的 |
| A | 将洁净的铜丝在酒精灯外焰灼烧后慢慢移向内焰 | 验证铜可作为乙醇氧化为乙醛的催化剂 |
| B | 向饱和碳酸钠溶液中通入CO2 | 比较相同温度下碳酸钠和碳酸氢钠的溶解度 |
| C | 用锌片和稀硫酸制备H2时,滴加几滴Cu(NO3)2溶液 | 加快制备H2的反应速率 |
| D | 向5mL0.1mol•L-1KI溶液中滴入0.1mol•L-1FeCl3溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 | 验证Fe3+与I-的反应可逆 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇在铜做催化剂条件下加热能够被氧化成乙醛;
B.向饱和碳酸钠溶液中通入CO2,会析出碳酸氢钠晶体,从而可比较二者溶解度大小;
C.硝酸根离子在酸性条件下具有强氧化性,与锌反应不会生成氢气;
D.碘离子过量,取上层清液滴加KSCN溶液,若溶液呈红色可证明该反应为可逆反应.
解答 解:A.铜丝在酒精灯上加热后产生氧化铜,反应的方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,再移至内焰,内焰含有乙醇,发生的反应方程式为:CuO+CH3CH2OH$\stackrel{△}{→}$Cu+CH3CHO+H2O,因此铜丝恢复成原来的红色,据此验证铜可作为乙醇氧化为乙醛的催化剂,故A正确;
B.向饱和碳酸钠溶液中通入CO2,析出了碳酸氢钠晶体,证明碳酸氢钠的溶解度较小,故B正确;
C.用锌片和稀硫酸制备H2时,滴加几滴Cu(NO3)2溶液,硝酸根离子在酸性条件下具有强氧化性,与锌反应不会生成氢气,无法达到实验目的,故C错误;
D.滴加KSCN溶液,观察溶液是否变血红色,说明溶液中存在铁离子,由于加入FeCl3溶液较少,若不存在限度,加入KSCN溶液后,溶液是不变色,说明该反应存在限度,故D正确;
故选C.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及碳酸钠与碳酸氢钠性质、乙醇的催化氧化、稀硝酸性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:实验题
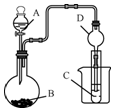 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的Na2CO3溶液中:c(CO32-)═2c(HCO3-)+c(H+)-c(OH-) | |
| B. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向3.0L0.1mol/LNaOH溶液中缓慢通入CO2至溶液增重8.8g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 等物质的量的CH3COOH、CH3COONa混合溶液PH=4.75中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量不变 | |
| C. | 该燃料电池的总反应式为:2H2+O2═2H2O | |
| D. | 该电池工作时每消耗1molO2,有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 适量的HCl | B. | 适量的NaCl | C. | 适量的氨水 | D. | NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com