
| A. | Cu(OH)2与H2SO4 | B. | Ba(OH)2与H2SO4 | C. | Fe(OH)3与HCl | D. | HNO3与KOH |
分析 强酸与可溶性强碱反应生成可溶性盐和水的离子反应可用H++OH-=H2O表示,碱必须是可溶性的强碱,不能是氢氧化铁、氢氧化铜等,反应生成的盐必须是可溶性的,据此进行判断.
解答 解:A.Cu(OH)2为难溶物,离子方程式中不能拆开,Cu(OH)2与硫酸的反应的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,不能用H++OH-=H2O表示,故错误;
B.氢氧化钡和硫酸反应的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,不能用H++OH-=H2O表示,故B错误;
C.氢氧化铁在离子反应中保留化学式,其反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,不能用H++OH-=H2O表示,故B错误;
D.硝酸和KOH都是强电解质,其反应的离子反应为:H++OH-=H2O,满足条件,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高考常见题型,题目难度中等,侧重学生思维严密性的考查,注意掌握反应实质及离子反应的书写方法,试题培养了学生的分析能力及规范答题能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
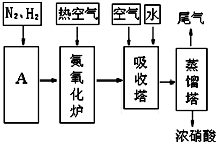
 CO+3H2.
CO+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
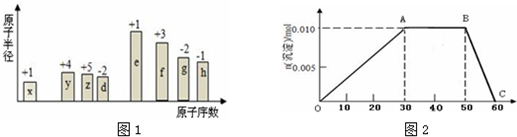
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1mol氦气含有的原子数为NA | |
| B. | 标准状况下,5.6L四氯化碳含有的分子数为0.25NA | |
| C. | 标准状况下,32gSO2的体积约为22.4L | |
| D. | 物质的量浓度为1mol•L-1的K2SO4溶液中,含2NA个K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量NaOH固体时动作过于缓慢 | B. | 向容量瓶中加水定容时俯视 | ||
| C. | 有少量NaOH溶液残留在烧杯里 | D. | 称量时误用“左码右物” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.
人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+等离子.某厂技术人员设计了如下方案,使上述离子的浓度降低到排放标准,且得到了纯度较高的镍粉.| 金属元素 | Ni | Mn | Co | Fe | Cu | Zn |
| 浓度(g•L-1) | 45 | 15 | 7.5 | ≤0.1 | ≤0.05 | ≤0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com