
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
| ||
| ||


科目:高中化学 来源: 题型:
| A、少量明矾溶液加入到过量NaOH溶液中 |
| B、往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液 |
| C、少量Na2O2固体加入到过量NaHSO3溶液中 |
| D、往酸性高锰酸钾溶液中滴入少量Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| B、达到化学平衡时,4v正(O2)=5v逆(NO) |
| C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D、化学反应速率关系是:v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:


 (苯胺,易被氧化)
(苯胺,易被氧化)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
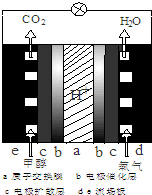 以甲醇为替代燃料是解决我国石油资源短缺的重要措施.
以甲醇为替代燃料是解决我国石油资源短缺的重要措施.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、砹易溶于某些有机溶剂 |
| B、砹化氢很不稳定易分解 |
| C、砹是有色气体 |
| D、砹化银不溶于水或稀HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com