
在10L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
C
【解析】
试题分析:A、实验①中,若5min时测得n(M)=0.050mol,浓度是0.0050mol/L,则根据反应的化学方程式可知,同时生成的N的物质的量也是0.0050mol/L ,因此0至5min时间内,用N表示的平均反应速率υ(N)=0.0050mol/L ÷5min=1.0×10-3mol/(L·min),A错误;B、实验②中,平衡时M的浓度是0.0080mol/L,则同时生成的N的浓度是0.0080mol/L,消耗X与Y的浓度均是0.0080mol/L,因此平衡时X和Y的浓度分别为0.01mol/L-0.0080mol/L=0.002mol/L,0.04mol/L-0.0080mol/L=0.032mol/L,因此反应的平衡常数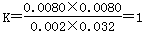 ,B错误;C、根据反应的化学方程式可知,如果X的转化率为60%,则
,B错误;C、根据反应的化学方程式可知,如果X的转化率为60%,则
X(g) + Y(g) M(g) + N(g)
M(g) + N(g)
起始浓度(mol/L) 0.020 0.030 0 0
转化浓度(mol/L)0.012 0.012 0.012 0.012
平衡浓度(mol/L)0.008 0.018 0.012 0.012
温度不变,平衡常数不变,则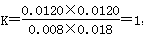 ,即反应达到平衡状态,因此最终平衡时X的转化率为60%。C正确;D、700℃时
,即反应达到平衡状态,因此最终平衡时X的转化率为60%。C正确;D、700℃时
X(g) + Y(g) M(g) + N(g)
M(g) + N(g)
起始浓度(mol/L) 0.040 0.010 0 0
转化浓度(mol/L) 0.009 0.009 0.009 0.009
平衡浓度(mol/L)0.031 0.001 0.009 0.009
则该温度下平衡常数 ,这说明升高温度平衡常数减小,即平衡向逆反应方向移动,因此正方应是放热反应。若容器④中温度也是800℃,由于反应前后体积不变,则与③相比④平衡是等效的,因此最终平衡时M的物质的量b=0.5a=0.06。当温度升高到900℃时平衡显逆反应方向移动,因此b<0.060,D错误,选C。
,这说明升高温度平衡常数减小,即平衡向逆反应方向移动,因此正方应是放热反应。若容器④中温度也是800℃,由于反应前后体积不变,则与③相比④平衡是等效的,因此最终平衡时M的物质的量b=0.5a=0.06。当温度升高到900℃时平衡显逆反应方向移动,因此b<0.060,D错误,选C。
考点:考查化学反应速率和化学平衡常数的有关判断与计算。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、①②④ | B、②③⑥ |
| C、②④⑥ | D、②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:填空题
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是______________,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为________________;若四种离子的关系符合④,则溶质为__________________。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。


若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高一上学期10月月考化学试卷(解析版) 题型:填空题
(6分)生态农业涉及农家废料的综合利用,某种废料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是________ 。
(2)原混合气体中氮气的体积分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高一上学期10月月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液的叙述不正确的是
A.2 L溶液中阴阳离子总数为1.2NA
B.500 mL溶液中NO3-浓度为0.2 mol/L
C.500 mL溶液中Ba2+浓度为0.2 mol/L
D.500 mL溶液中NO3-物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高一上学期10月月考化学试卷(解析版) 题型:选择题
利用给定的实验器材(规格和数量不限),能完成相应实验的一项是
| 实验器材(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去硫酸钾中的少量碳酸钾 |
C | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
D | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体氯化钠配制0.5mol/L的溶液 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省五校协作体高二上学期期中化学试卷(解析版) 题型:选择题
下列实验不能达到实验目的的是
①实验窒用无水乙醇和浓硫酸共热到140℃即可制取乙烯
②验证R—X是碘代烷,把R—X与NaOH水溶液混合加热,再往其中加入硝酸银溶液即可
③做醛的还原性实验,向乙醛溶液中加入新制的Cu(OH)2悬浊液即可得到红色沉淀
④检验淀粉已水解,将淀粉与水和稀硫酸加热一段时间后,加入银氨溶液即可
⑤实验室制备乙酸乙酯,把乙醇和乙酸及稀硫酸溶液共热即可
A.①②③④⑤ B.①③④ C.①②③⑤ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省五校协作体高二上学期期中化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大
C.升高温度通过降低活化能而加快化学反应速率
D.常温下,反应C(s)+CO2(g) === 2CO(g)不能自发进行,则该反应的△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com