
���� ��1���١��ڷ�Ӧ�к�ͭ������ֱ�ΪCu2S��Cu2O���ڸ�����Cu2S��Cu2O��Ӧ�õ�һ�����ȵ�ͭ�Ͷ����������壬����Ԫ���غ���д��ѧ����ʽ��
��2��Cu��Cu2O�Ļ������Һ������Һ������Cu2O�ܷ�������������ԭ��Ӧ������ͭ���Ӻ�ͭ���ʣ���ʹ��Һ����ɫ���Դ��ж�Cu2O�Ĵ��ڣ��ڴ˷����в�������ǿ�����Ե��ᣬ��Ϊͭ�ܱ�ǿ�����Ե���������ͭ���ӣ���ʵ��������ţ�
��3��Cu2O��ɫ����ת��Ϊ����ͭ��Һ��ʵ����̶Ի����Ѻ�����ʵ�����ŷţ������Ƚ�Cu2O������CuO������CuO�����ᷴӦ��������ͭ��
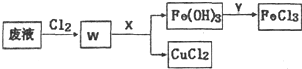
��4��ͭ��ӡˢ��·�Ŀ�ʴ��Һ�к��д�����CuCl2��FeCl2��FeCl3��ͨ���������Ȼ������������Ȼ�����������ͭ��������ͭ��̼��ͭ������Һ��pHֵ��ʹ�����Ӳ��������������������˺���Ȼ�ͭ��Һ���������������м���������Ȼ����������ܶȸ������ɼ����Ҫʹ�����ӳ�������ͭ���Ӳ�������pHֵ���ݴ˴��⣻
��� �⣺��1���١��ڷ�Ӧ�к�ͭ������ֱ�ΪCu2S��Cu2O���ڸ�����Cu2S��Cu2O��Ӧ�õ�һ�����ȵ�ͭ�Ͷ����������壬��Ӧ�Ļ�ѧ����ʽΪCu2S+2Cu2O$\frac{\underline{\;����\;}}{\;}$6Cu+SO2��
�ʴ�Ϊ��Cu2S+2Cu2O$\frac{\underline{\;����\;}}{\;}$6Cu+SO2��
��2��Cu��Cu2O�Ļ������Һ������Һ������Cu2O�ܷ�������������ԭ��Ӧ������ͭ���Ӻ�ͭ���ʣ���Ӧ�����ӷ���ʽΪCu2O+2H+=Cu2++Cu+H2O����ʹ��Һ����ɫ���Դ��ж�Cu2O�Ĵ��ڣ��ڴ˷����в�������ǿ�����Ե��ᣬ��Ϊͭ�ܱ�ǿ�����Ե���������ͭ���ӣ���ʵ��������ţ����Բ�����Ũ��������ᣬ��ѡCD��
�ʴ�Ϊ��CD��Cu2O+2H+=Cu2++Cu+H2O��
��3��Cu2O��ɫ����ת��Ϊ����ͭ��Һ��ʵ����̶Ի����Ѻ�����ʵ�����ŷţ������Ƚ�Cu2O������CuO������CuO�����ᷴӦ��������ͭ����Ӧ�Ļ�ѧ����ʽΪ2Cu2O+O2=4CuO��CuO+H2SO4=CuSO4+H2O��
�ʴ�Ϊ��2Cu2O+O2=4CuO��CuO+H2SO4=CuSO4+H2O��
��4��ͭ��ӡˢ��·�Ŀ�ʴ��Һ�к��д�����CuCl2��FeCl2��FeCl3��ͨ���������Ȼ������������Ȼ�����������ͭ��������ͭ��̼��ͭ������Һ��pHֵ������X�Ļ�ѧʽΪCuO��Cu��OH��2��CuCO3��ʹ�����Ӳ��������������������˺���Ȼ�ͭ��Һ���������������м���������Ȼ�����
ͭ���ӿ�ʼ����ʱ����Һ��c��OH-��=$\sqrt{\frac{Ksp[Cu��OH��{\;}_{2}]}{c��Cu{\;}^{2+}��}}$=$\sqrt{\frac{2��10{\;}^{-20}}{0.5}}$=2��10-10mol/L��c��H+��=$\frac{10{\;}^{-14}}{2��10{\;}^{-10}}$=5��10-5mol/L������Һ�����pH=-lg5��10-5=4.3��������Ũ�ȿ�ʼ����ʱ����Һ��c��OH-��=$\root{3}{\frac{Ksp[Fe��OH��{\;}_{3}]}{c��Fe{\;}^{3+}��}}$=$\root{3}{\frac{1.0��10{\;}^{-38}}{1��10{\;}^{-5}}}$=10-11mol/L��c��H+��=$\frac{10{\;}^{-14}}{10{\;}^{-11}}$=10-3mol/L������Һ����СpH=-lg10-3=3.0������ҺpHӦ������3.0��4.3֮�䣬
�ʴ�Ϊ��CuO��Cu��OH��2��CuCO3�� 3.0��4.3��
���� ���⿼��������ԭ��Ӧ���㼰������������������������ơ������ƶϡ��ܶȻ����йؼ���ȣ��Ѷ��еȣ���4����ע�������ܶȻ��������������㣬Ϊ�״��㡢�ѵ㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ�Ľṹ��ʽCH2CH2 | |
| B�� | ��ѧ���ʣ�������֬���������������� | |
| C�� | ��ͼ��ijһ�����ʵĽṹ��ʽ��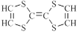 �����������һ���� �����������һ���� | |
| D�� | ����ϩ�Ļ�ѧ��ɱ�ʾʽΪ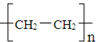 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
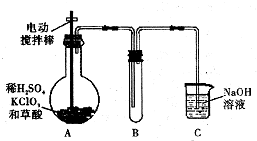 ClO2��һ�ָ�Чˮ��������ijʵ��С������ͼ��ʾװ����ȡ���ռ�Cl02����֪����ClO2Ϊ����ɫ���壬��������ˮ���۵�-59C���е�11�棬����ǿ�����ԣ�
ClO2��һ�ָ�Чˮ��������ijʵ��С������ͼ��ʾװ����ȡ���ռ�Cl02����֪����ClO2Ϊ����ɫ���壬��������ˮ���۵�-59C���е�11�棬����ǿ�����ԣ�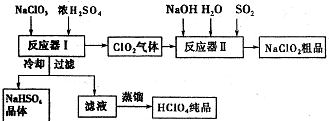
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.5g-CH3�к��еĵ�����Ϊ6.02��1023 | |
| B�� | ��״����.22.4L NO��11.2L O2��Ϻ�����ķ�������Ϊ1.0��6.02��1023 | |
| C�� | ��ҵ���õ�ⷨ������ͭʱ��ÿת��1mo1���ӣ��������ܽ��ͭԭ������Ϊ0.5��6.02��1023 | |
| D�� | VL amo1•L-1�Ȼ�����Һ�У���Fe3+����ĿΪ6.02��1023����Cl-����Ŀ����3��6.02��1023�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
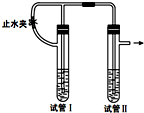 ����ͼװ���У���NaOH��Һ����м��ϡ������Լ��Ʊ�Fe��OH��2��
����ͼװ���У���NaOH��Һ����м��ϡ������Լ��Ʊ�Fe��OH��2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
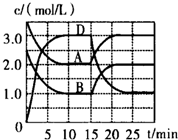 �¶�ΪTʱ����V L���ܱ������г���һ������A��B��������Ӧ��A��g��+B��g��?C��s��+xD��g����H��0��������A��B��D�����ʵ���Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ���ǣ�������
�¶�ΪTʱ����V L���ܱ������г���һ������A��B��������Ӧ��A��g��+B��g��?C��s��+xD��g����H��0��������A��B��D�����ʵ���Ũ����ʱ��ı仯��ͼ��ʾ������˵������ȷ���ǣ�������| A�� | ��Ӧ��ǰ10min��ƽ����Ӧ����v��B��=0.15mol/��L•min�� | |
| B�� | �÷�Ӧ��ƽ�ⳣ������ʽK=$\frac{{c}^{2}��D��}{c��A��•c��B��}$ | |
| C�� | ��ƽ��ʱ�����¶Ȳ��䣬ѹ���������ƽ�����淴Ӧ�����ƶ� | |
| D�� | ��Ӧ��1.5minʱ���ı�ķ�Ӧ�����ǽ����¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
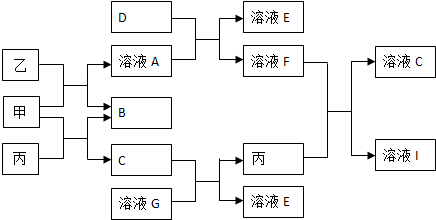
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�鲽�� | ʵ������ | ʵ����� | |
| ����� | ȡ����NaOH��������ձ��У�����������ˮ�����裬����һ֧�¶ȼ� ������Һ�¶ȣ� | ��Һ�¶ȱ��� ���������� | �������� �������� ˮ���� |
| ����� | ��������õ��� Һ��ȴ�����£��ý�ͷ�ιܽ�ϡ������뵽��������õ���Һ�� | ��Һ�¶ȱ��� ���������� | ����������ϡ�� �ᷴӦ��ų����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com