
| ||
| ||
| y-2x |
| 2 |
| y-2x |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量的氨水 |
| B、MgCl2溶液中加入过量的氨水 |
| C、Al2(SO4)3溶液中加入过量的KOH溶液 |
| D、MgSO4溶液中加入过量的KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
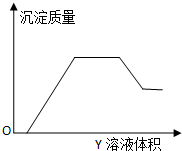 向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )
向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,表中符合图象的一组是( )| X | Y | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

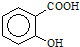 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:
- 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
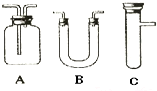 浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
浓H2SO4和木炭在加热时发生反应的化学方程式是2H2SO4(浓)+C
| ||
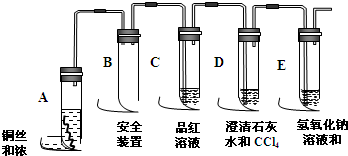
| 选用的仪器 (填字母) | 加入的试剂 | 作用 |
| C | 浓H2SO4、木炭 | 发生反应 |
| B | 检验产物水 | |
| A | 检验SO2 | |
| A | 酸性KMnO4溶液 | |
| A | 品红 | |
| A | 检验CO2的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
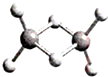 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物Al2H6的球棍模型如图所示,它的熔点为150℃,燃烧热极高.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物Al2H6的球棍模型如图所示,它的熔点为150℃,燃烧热极高.下列说法错误的是( )| A、氢铝化合物与水反应生成氢氧化铝和氢气 |
| B、Al2H6中含有离子键和极性共价键 |
| C、氢铝化合物可能成为未来的储氢材料和火箭燃料 |
| D、氢铝化合物中可能存在组成为AlnH2n+2的物质(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5mol |
| B、当SO42-恰好完全沉淀时,Al3+全部转化为AlO2- |
| C、随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
| D、当向溶液中加入1.5mol Ba(OH)2时,反应可用离子方程式2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓表示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com