
 氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.
氟元素是电负性最大的非金属元素,且氟原子的半径小,因此氟单质极易和金属单质反应且把它们氧化到最高价态,如MnF7、VF5、CaF2等.氟元素还可以和氧元素形成氟化物,如OF2等.分析 (1)V原子是23号,其核外电子排布式为1s22s22p63s23p63d34s2(或[Ar]3d34s2);利用均摊法计算钙离子和氟离子的个数,然后判断;把晶胞分成8个小的立方体如图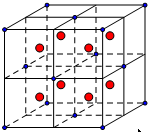 ,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半;
,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半;
(2)根据O原子的价层电子对数判断;根据OF2中O元素的化合价分析.
解答 解:(1)V原子是23号,其核外电子排布式为1s22s22p63s23p63d34s2(或[Ar]3d34s2);CaF2晶胞中,白球的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑球全部在晶胞内部,数目为8,则图中白球是钙离子;把晶胞分成8个小的立方体如图 ,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半,已知晶胞边长为a,则小立方体的边长为$\frac{a}{2}$,设Ca2+与F-之间的最近距离为x,
,则F-位于小立方体的中心,即小红球,则Ca2+与F-之间的最近距离为小立方体的体对角线的一半,已知晶胞边长为a,则小立方体的边长为$\frac{a}{2}$,设Ca2+与F-之间的最近距离为x,
则( $\frac{a}{2}$)2+( $\frac{a}{2}$)2+( $\frac{a}{2}$)2=x2,解得x=$\frac{\sqrt{3}a}{4}$;
故答案为:1s22s22p63s23p63d34s2(或[Ar]3d34s2);Ca2+;$\frac{\sqrt{3}a}{4}$;
(2)OF2分子中氧原子为2+$\frac{1}{2}$(6-2×1)=4,属于sp3杂化;OF2中F元素为-1价,O元素的化合价为+2价,而氧化物中O元素的化合价为-2价,所以OF2被称为氟化物;
故答案为:sp3;氧化物中氧元素的化合价为-2价,而在OF2中氧元素的化合价为+2价.
点评 本题考查了电子排布式、晶胞的分析与计算、杂化理论的应用等,题目涉及的知识点较多,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意把握晶胞的计算方法


科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙醇均能被酸性高锰酸钾溶液氧化 | |
| B. | 甲烷和苯均可在光照的条件下与氯气发生取代反应 | |
| C. | 分子式为C2H6O的有机物均可在一定条件下与乙酸发生酯化反应 | |
| D. | 蛋白质、油脂、葡萄糖均可在一定条件下发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸有吸水性 | |
| B. | 盐酸有挥发性 | |
| C. | 气态溶质的溶解度随温度开高而降低 | |
| D. | 浓硫酸有脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 | |
| B. | 积极推广太阳能、风能等新能源的使用,减少化石燃料的使用 | |
| C. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| D. | 加高烟囱,减少烟尘对周围环境的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
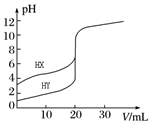 常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1 NaOH溶液分别滴定20.00mL 0.10mol•L-1 的HX和HY溶液,滴定曲线如图所示.下列说法正确的是( )| A. | pH=7时,滴定HX消耗NaOH溶液体积等于20.00 mL | |
| B. | 将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH (HX) | |
| C. | 当NaOH溶液体积为20.00 mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

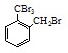 ;
;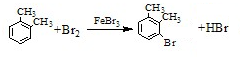 ;
;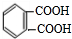 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
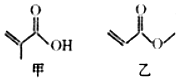
| A. | 甲和乙互为同分异构体 | |
| B. | 甲和乙都能发生取代反应 | |
| C. | 甲和乙中都有3种不同化学环境的氢 | |
| D. | 1mol甲和1mol乙都能与2molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 1 L pH=1的硫酸溶液中含有的H+数为0.2NA | |
| C. | 由1 mol NH4Cl和少量氨水形成的中性溶液中,NH4+数目小于NA个 | |
| D. | 在标准状况下,2.24L的C12溶于水,充分反应后转移电子数一定为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com