
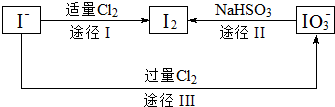
分析 (1)根据NaHSO3的组成可知,NaHSO3是强碱弱酸的酸式盐,据此答题;
(2)工业上用电解饱和食盐水制氯气;
(3)氯气具有强氧化性,能将碘离子氧化为碘,自身被还原为氯离子;
(4)氧化剂中Cl元素化合价由0价变为-1价、还原剂中I元素化合价由-1价变为+5价,根据转移电子相等配平方程式,从而确定氧化剂和还原剂的物质的量之比;
(5)酸性条件下,IO3-和HSO3-发生氧化还原反应生成SO42-、H+和I2.
解答 解:(1)根据NaHSO3的组成可知,NaHSO3是强碱弱酸的酸式盐,是强电解质,故选BD;
(2)工业上用电解饱和食盐水制氯气,反应的方程式为2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
(3)氯气具有强氧化性,能将碘离子氧化为碘,自身被还原为氯离子,离子方程式为C12+2I-=2C1-+I2,
故答案为:C12+2I-=2C1-+I2;
(4)氧化剂中Cl元素化合价由0价变为-1价、还原剂中I元素化合价由-1价变为+5价,根据转移电子相等配平方程式为3Cl2+I-+3H2O=6Cl-+IO3-+6H+,根据方程式知,氧化剂和还原剂的物质的量之比为3:1,
故答案为:3:1;
(5)酸性条件下,IO3-和HSO3-发生氧化还原反应生成SO42-、H+和I2,离子反应方程式为2IO3-+5HSO3-=5SO42-+H2O+3H++I2,
故答案为:2IO3-+5HSO3-=5SO42-+H2O+3H++I2.
点评 本题考查海水资源综合利用,涉及氧化还原反应,明确物质的性质及离子方程式书写规则即可解答,会根据转移电子相等配平方程式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 42.0g | B. | 21.3g | C. | 7.1g | D. | 3.55g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
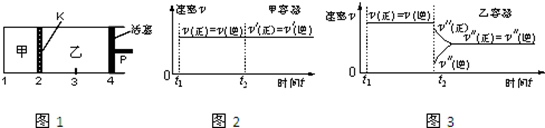
| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中 C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑥⑦ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与水反应 | B. | 与氢氧化钠溶液反应 | ||
| C. | 与硫酸反应 | D. | 与前三种物质均能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光伏发电主要利用高纯度单质硅制成的硅太阳能电池 | |
| B. | 硅太阳能电池可将太阳能直接转化为电能,减少化石燃料的使用,保护环境 | |
| C. | 硅的结构和金刚石类似,是具有金属光泽的灰黑色固体 | |
| D. | 硅单质即能与氢氧化钠反应又能与氢氟酸反应,所以硅是两性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com