
| A. | 64g Cu粉与足量硫粉加热完全反应生成Cu2S时失去的电子数为2NA | |
| B. | 足量的CO2与39gNa2O2发生反应转移的电子数为NA | |
| C. | 18g的D2O与NA个-CH3具有相同的电子数 | |
| D. | 6.0g醋酸晶体中含有H+的数目为0.1NA |
分析 A、求出铜的物质的量,然后根据铜和硫反应后变为+1价来分析;
B、求出过氧化钠的物质的量,然后根据过氧化钠与二氧化碳反应时,1mol过氧化钠转移1mol电子;
C、重水的摩尔质量为20g/mol;
D、醋酸晶体中不含氢离子.
解答 解:A、64g铜的物质的量为1mol,而铜和硫反应后变为+1价,故1mol铜失去NA个电子,故A错误;
B、39g过氧化钠的物质的量为0.5mol,而过氧化钠与二氧化碳反应时,1mol过氧化钠转移1mol电子,故0.5mol过氧化钠转移0.5NA个电子,故B错误;
C、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,则含9NA个电子;-CH3含9个电子,故NA个甲基中含9NA个电子,故C正确;
D、醋酸晶体中不含氢离子,为氢原子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
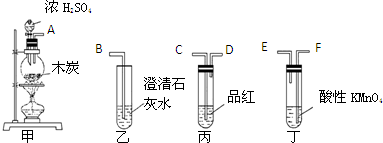
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序为:M>W>Z>Y>X | |
| B. | X、Y、Z、W四种元索都属于非金属元素,它们之间只能形成共价化合物 | |
| C. | Y、Z、W、M四种元素与X元素分别形成的最简单化合物的沸点依次升高 | |
| D. | X、M均可与W形成可用于自来水杀菌消毒的强氧化性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
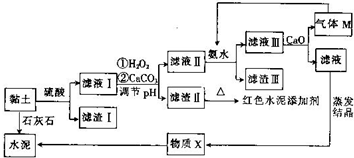
| Fe(OH)2 | Fe(OH)3 | Al(OH)3 | |
| 开始沉淀时的pH | 6.3 | 1.9 | 3.4 |
| 完全沉淀时的pH | 8.3 | 3.2 | 4.7 |
 ;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).
;向滤液Ⅲ中加入CaO的作用是与水反应放热,降低NH3的溶解度(任写一条).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
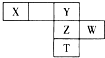 如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )
如图下表为元素周期表的一部分,X、Y、Z、W为短周期元素,其中X的最高正价与最低负价绝对值只差等于0.下列说法正确的是( )| A. | X氢化物的沸点一定比Y氢化物的沸点低 | |
| B. | T的最高价氧化物对应的水化物酸性比Z的强 | |
| C. | Y的氢化物沸点高于Z的氢化物,因为H-Y键的键能高于H-Z键 | |
| D. | XY2、XZ2、XW4的化学键类型相同、晶体类型也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com