
| A. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 | |
| B. | 加入NaOH溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO3溶液 | |
| C. | 在溴乙烷中直接加入AgNO3溶液 | |
| D. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 |
分析 先将溴乙烷中的溴元素转化为溴离子,硝酸银和溴离子反应生成不溶于酸的浅黄色沉淀,所以再用硝酸银溶液检验溴离子是否存在,从而证明溴乙烷中是否含有溴元素.
解答 解:在NaOH水溶液中加热,溴乙烷水解脱掉-Br生成Br-,再加HNO3酸化(NaOH过量,下一步加的Ag+会和OH-反应变成不稳定的AgOH,近而变成白色沉淀Ag2O,影响实验,所以加H+把OH-除掉),再加AgNO3溶液,如果生成浅黄色沉淀,则证明溴乙烷中含有溴元素,
故选B.
点评 本题考查物质的检验和鉴别的设计,侧重于学生的分析能力和实验能力的考查,易错点为卤代烃水解是碱性溶液中进行或在在氢氧化钠醇溶液中发生消去反应,加硝酸银时必须先加酸中和碱才能出现溴化银沉淀,注意实验的操作步骤.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
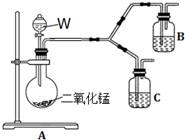 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.| 步 骤 | 现 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
| Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
| Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
| Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
| Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
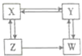 X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )
X、Y、Z、W为醇、醛、酸、酯中的一种,它们之间存在如图所示的转化关系.下列判断正确的是( )| A. | X是羧酸,Y是酯 | B. | Y是醛,W是醇 | C. | Z是醛,W是羧酸 | D. | X是醇,Z是酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应 2CH3COOH+Cu(OH)2═(CH3COO)2Cu+2 H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
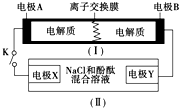 下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )
下图为一种可充电电池的示意图,其中的离子交换膜只允许K+通过,该电池放电、充电的化学反应方程式为:2K2S2+KI3 $?_{充电}^{放电}$K2S4+3KI.装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红.则闭合K时,下列说法正确的是( )| A. | K+从左到右通过离子交换膜 | |
| B. | 电极A上发生的反应为:3I--2e-═I3- | |
| C. | 电极X上发生的反应为:2Cl--2e-═Cl2↑ | |
| D. | 当有0.1 mol K+通过离子交换膜,X电极上产生1.12 L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
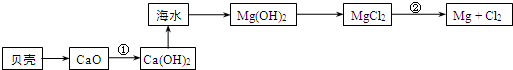
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液用带玻璃塞的玻璃瓶存放 | |
| B. | 金属钠保存在水中 | |
| C. | 浓硝酸存放于无色细口瓶中 | |
| D. | 浓硫酸贮存在铝制容器中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径大小:F->Na+>Mg2+ | B. | 金属性强弱:K>Mg>Ca | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:LiOH>NaOH>KOH? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 Cl2 H2 | B. | NO CO2 O2 | C. | NH3 N2 HCl | D. | H2S O2 SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com