
【题目】下列有关金属的说法中,正确的是( )
①纯铁较生铁不易生锈 ②冶炼铝和钠都可以用电解法
③KSCN溶液可以检验Fe3+离子 ④缺钙会引起骨质疏松,缺铁会引起贫血
⑤青铜、不锈钢、硬铝都是合金 ⑥铜与硫反应,生成黑色的CuS
A. ①②③④⑤ B. ②③④⑤⑥ C. ①③④⑤ D. ①②③④⑤⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.AgNO3 B.NaCl C.CuCl2 D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制高能量电池,已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )
A.电解法
B.热还原法
C.热分解法
D.铅热法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟 B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应 D.生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业采用氯化铵焙烧菱锰矿制备碳酸锰的流程如下图所示:
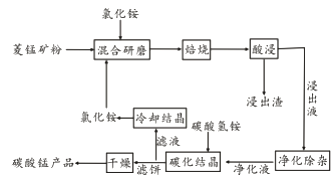
已知:①菱锰矿的主要成分是MnCO3 ,其中含Fe、Ca、Mg、Al等元素。
②焙烧过程中主要反应为:MnCO3 +2NH4Cl ![]() MnCl2+2NH3↑ +CO2↑+ H2O。
MnCl2+2NH3↑ +CO2↑+ H2O。
③部分阳离子沉淀时溶液的pH的值:
Al3- | Fe3+ | Ca2+ | Mn2+ | Mg2+ | |
开始沉淀的pH值 | 4.1 | 2.2 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH值 | 4.7 | 3.2 | 13.1 | 10.1 | 11.1 |
(1)实验室“焙烧”操作盛放固体的仪器为____________________。
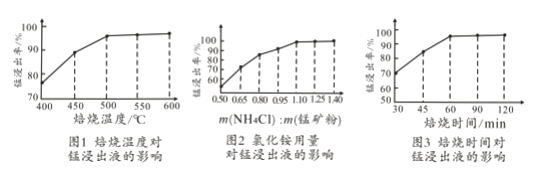
(2)结合图1、2、3,分析焙烧过程中对温度、NH4Cl用量[m(NH4Cl):m(锰矿粉)]、时间的最佳选择依次为________________、_______________、______________。
(3)对锰浸出液净化除杂时,先加入MnO2将Fe2+转化为Fe3+,再调节溶液pH的范围为_________________,将Fe3+和Al3+变为沉淀除去。然后加入NH4F将Ca2+、Mg2+变为氟化物沉淀除去。
(4)“碳化结晶”步骤中,加入碳酸氢铵是反应的离子方程式为________________。
(5)上述流程中可循环使用的物质是_______________。
(6)为测定产品中碳酸锰的含量,设计如下实验(杂质不参加反应):实验步骤为:称取16.80g试样,溶于适量的稀硫酸溶液中,向所得溶液中加入稍过量的磷酸和硝酸,加热使反应:2Mn2++NO3-+4PO43-+2H+![]() 2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
2[Mn(PO4)2]3-+NO2-+H2O充分进行。除去溶液中存在的NO3-和NO2-后,加入l00.00mL2.00 mol·L-1的(NH4)2Fe(SO4)2溶液,发生的反应为:[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO3-;再用1.00mol·L-1酸性K2Cr2O7溶液滴定过量的Fe2+,滴定终点时消耗10.00mL酸性K2Cr2O7溶液。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________(还原产物是Cr3+。
②产品中碳酸锰的质量分数为_____________(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)![]() C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是
C(s)+xD(g);△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示。下列说法不正确的是

A.反应在前10min的平均反应速率v(B)=0.15mol/( L ·min)
B.该反应的平衡常数表达式K=![]()
C.若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动
D.反应至15min时,改变的条件是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组的同学们利用下图装置,探究不同条件对铁与酸反应速率的影响。
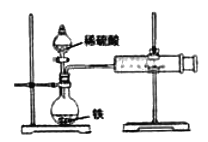
请回答下列问题。
(1)铁与稀硫酸反应的离子方程式是_______________________________________。
(2)适当升高烧瓶内液体的温度,产生气泡的速率将__________(填“加快、”“减慢”或“不变”),由此得出的结论是______________________________________________。
(3)将稀硫酸换为浓硫酸,可观察到_______________,原因是_________________。
(4)向烧瓶中滴入几滴CuSO4溶液,产生气泡的速率明显加快。这是什么原因?
甲同学:CuSO4溶液中的Cu2+对铁与稀硫酸的反应起了催化作用。
乙同学:CuSO4与Fe反应生成了Cu,从而Fe、Cu、稀硫酸构成了原电池,使反应速率加快。
你同意_______的观点,欲证明此观点,可另取一套上图装置,向烧瓶中直接加入少量_____,观察现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法不正确的是
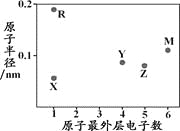
A. R的氧化物都含有离子键
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. Y形成的化合物种类最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
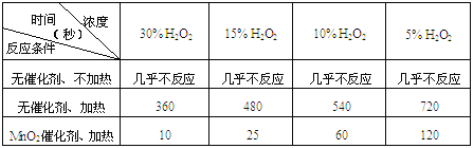
①该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响: 。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生的化学反应方程式 _______________ ______。
②实验结果说明催化剂作用的大小与________ _________ 有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com