

 ,由D合成该物质发生缩聚反应,则D为
,由D合成该物质发生缩聚反应,则D为 ,D由C氧化生成,则C为
,D由C氧化生成,则C为 ,由B发生水解反应生成C,A发生取代反应生成B,且A的相对分子质量小于110,其中碳的质量分数约为0.9,则C、H原子个数比为
,由B发生水解反应生成C,A发生取代反应生成B,且A的相对分子质量小于110,其中碳的质量分数约为0.9,则C、H原子个数比为| 0.9 |
| 12 |
| 0.1 |
| 1 |
 ,然后结合物质的结构、性质来解答.
,然后结合物质的结构、性质来解答. ,由D合成该物质发生缩聚反应,则D为
,由D合成该物质发生缩聚反应,则D为 ,D由C氧化生成,则C为
,D由C氧化生成,则C为 ,由B发生水解反应生成C,A发生取代反应生成B,且A的相对分子质量小于110,其中碳的质量分数约为0.9,则C、H原子个数比为
,由B发生水解反应生成C,A发生取代反应生成B,且A的相对分子质量小于110,其中碳的质量分数约为0.9,则C、H原子个数比为| 0.9 |
| 12 |
| 0.1 |
| 1 |
 ,
, ,该反应过程中生成的不稳定中间体的结构简式为
,该反应过程中生成的不稳定中间体的结构简式为 ,
, ;
; ;
; ,D生成高分子材料的方程式为n
,D生成高分子材料的方程式为n
| 浓硫酸 |
| △ |
 +nH2O,其同分异构体中含有苯环且水解产物之一为乙酸的有为
+nH2O,其同分异构体中含有苯环且水解产物之一为乙酸的有为 ,共3种,
,共3种,
| 浓硫酸 |
| △ |
 +nH2O;3;
+nH2O;3; (其中之一).
(其中之一).


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COOH) |
| c(CH3COO-) |
c(HC
| ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12L氧气 |
| B、1.12L氢气 |
| C、2.24L氢气 |
| D、2.24L氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:


| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
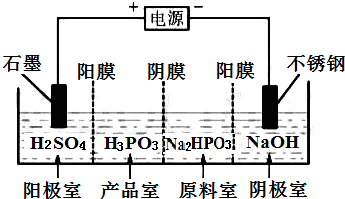 亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.
亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:
 据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol
据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O (g)?4NH3(g)+3O2(g)△H=Q kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com