
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c((NH4+)_________(填“等于”、“大于”或“小于”) 0.1 mol·L-1NH4HSO4溶液中c(NH4+)
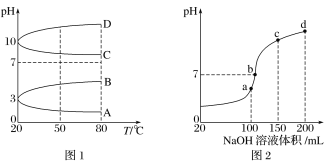
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是______(填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2溶液中2c(SO42-)- c(NH4+)-3c(Al3+)=________ mol·L-1
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。 试分析图中a、b、c、d四个点,水的电离程度最大的是____________; 在b点,溶液中各离子浓度由大到小的排列顺序是___________________。
(4)用0.1mol/LNaOH溶液滴定盐酸溶液,下列操作中使结果偏高的是___________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前盛标准液的滴定管尖嘴处有气泡未排除,滴定后气泡消失
【答案】小于 A 10-3(或10-3-10-11) a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) AD
【解析】
(1)NH4Al(SO4)2中Al3+水解使溶液显酸性,可抑制NH4+的水解,HSO4-电离出H+,也能抑制NH4+的水解;
(2)①NH4Al(SO4)2水解使溶液显酸性,升高温度其水解程度增大;
②根据电荷守恒分析解答;
(3)a、b、c、d4个点,a点恰好将H+消耗完,溶液中只有(NH4)2SO4与Na2SO4,b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性;
(4)根据c(待测)=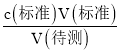 判断不当操作度相关物理量的影响。
判断不当操作度相关物理量的影响。
(1)NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但NH4Al(SO4)2中Al3+水解使溶液显酸性,可抑制NH4+的水解,HSO4-电离出H+,也能抑制NH4+的水解,因HSO4-电离出的H+浓度大于Al3+水解生成的H+浓度,因此NH4HSO4溶液中c((NH4+)小于0.1 mol·L-1NH4HSO4溶液中c(NH4+);
(2)①NH4Al(SO4)2水解使溶液显酸性,升高温度其水解程度增大,pH减小,符合的曲线为A;
②根据电荷守恒,可以得出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3mol/L-10-11mol/L≈10-3mol/L;
(3)a、b、c、d4个点,a点恰好将H+消耗完,溶液中只有(NH4)2SO4与Na2SO4,b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性,即溶液中含有NH3H2O、(NH4)2SO4、Na2SO4三种成分,a点c(Na+)=c(SO42-),b点c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),因此有:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(4)A. 盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定,标准液浓度减小,所需标准液的体积增大,导致待测液的浓度偏高,A项正确;
B. 锥形瓶用蒸馏水洗涤后未用待测液润洗,所需的标准液的体积不变,导致待测液的浓度不变,B项错误;
C. 读取标准液读数时,滴定前平视,滴定到终点后俯视,所需标准液的体积偏小,导致待测液的浓度偏小,C项错误;
D. 滴定前盛标准液的滴定管尖嘴处有气泡未排除,滴定后气泡消失,所需标准液的体积偏大,导致待测液的浓度偏大,D项正确;
答案选AD。


科目:高中化学 来源: 题型:
【题目】(16分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
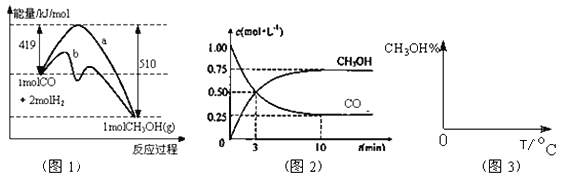
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡, v(H2)=_____;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI 与Cu(NO3)2 的反应,进行实验一:

注: 本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验: 向2mL Imol/LKI 溶液中加入1mL______溶液( 硝酸酸化,pH=1.5 ),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论: 实验一中生成I2 的原因是酸性条件下,NO3- 氧化了I-。
②乙同学认为仅由甲同学的实验还不能得出相应结论。他的理由是该实验没有排除____氧化I-的可能性。
③若要确证实验一中是NO3-氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知: CuI 为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2; b.______吸附I2。
为证明上述假设是否成立,取棕黑色沉淀进行实验二:

已知: CuI难溶于CCl4;I2+2S2O32-=2I-+S4O62-(无色);Cu++2S2O32-=Cu(S2O3)23-(无色)。
由实验二得出结论: 棕黑色沉淀是CuI吸附I2 形成的。
②现象ⅲ为______________。
③用化学平衡移动原理解释产生现象ii 的原因:________________。
④由实验二可推知,Cu(NO3)2 与KI 反应过程中,一定发生的反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯常用于食用香精配方中,可调配香蕉、苹果、草莓等多种果香型香精。实验室制备乙酸异戊酯的反应为CH3COOH+(CH3)2CHCH2CH2OH![]() CH3COOCH2CH2CH(CH3)2+H2O,实验装置如图所示。
CH3COOCH2CH2CH(CH3)2+H2O,实验装置如图所示。
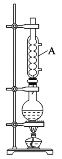
实验步骤如下:①在100 mL圆底烧瓶中加入一定体积的异戊醇和冰乙酸,摇匀后小心加入4 滴浓硫酸,投入1~2粒沸石。如图装置隔石棉网用酒精灯加热,回流反应30 min。
②待反应物冷却至室温,将其转移到100 mL分液漏斗中,依次用蒸馏水荡洗圆底烧瓶两次,荡洗液全部转入分液漏斗中,静置分层分离,弃水层,有机层加入NaHCO3溶液不断振荡,静置分层,分去水层。
③分出水层后的有机层转入干燥的锥形瓶中,加入约0.10 g无水硫酸镁,加盖静置10 min。然后液体转入100 mL圆底烧瓶中,加两粒沸石,装上直形冷凝管、接液管,常压下蒸馏,收集140~143℃馏分得产物。
(1)步骤①中加入沸石的目的是______,仪器A的名称是______。
(2)步骤②中,水洗的主要目的是______,NaHCO3洗涤完成的标志是______。
(3)步骤③中加入少量无水MgSO4的目的是______。
(4)用测相对分子质量的方法可检验所得产物是否纯净,测相对分子质量通常采用的仪器是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍; W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是:
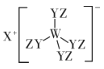
A.原子半径:W<X<Y<Z
B.简单离子的氧化性:W> X
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com