
����Ŀ��(2017�������е�����ѧ��һ��ѧ����ĩ����)���������Ǽ���ʵ���г��õ�������
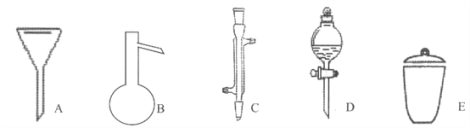
д����������������������ƣ�
A__________��B__________��C__________��D__________��E__________��
����ʵ����Ҫ����100 mL 2 mol/L NaCl��Һ����ش��������⣺
(1)���ƹ�������Ҫʹ�õ���Ҫ�������������ձ�������������ͷ�ιܡ���ƽ����Ͳ��__________________��
(2)��������ƽ��ȡ�Ȼ��ƹ��壬������Ϊ__________g��
(3)������Ҫ�����������ȷ˳����____________________(�����)��
����ȡһ���������Ȼ��ƣ������ձ��У�����������ˮ�ܽ⣻
����ˮ��Һ��������ƿ���̶�����1��2����ʱ�����ý�ͷ�ιܵμ�����ˮ����Һ����̶������У�
������Һת�Ƶ�����ƿ�У�
���Ǻ�ƿ�����������µߵ���ҡ�ȣ�
������������ˮϴ���ձ��ڱںͲ�����2��3�Σ�ϴ��Һת�Ƶ�����ƿ�С�
(4)���ʵ�������ȱ�ٲ������������������Һ�����ʵ���Ũ��__________ (�ƫ�ߡ���ƫ�͡�����Ӱ�족)��
���𰸡�
����©�� ������ƿ ������ ��Һ©�� ����
����(1)100 mL����ƿ
(2)11.7
(3)�٢ۢݢڢ�
(4)ƫ��
��������
������������ͼ�ο�֪AΪ©����BΪ������ƿ��CΪ�����ܣ�DΪ��Һ©����EΪ������
����(1)�ù�������һ�����ʵ���Ũ����Һ��һ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȵȣ��õ���������������ƽ��ҩ�ס��ձ���������������ƿ����ͷ�ιܣ�����100 mL 2 mol/L NaCl��Һ��Ӧѡ��100 mL����ƿ�����Ի�ȱ�ٵ�������100 mL����ƿ��
(2)����100 mL 2 mol/L NaCl��Һ����Ҫ���ʵ�����Ϊ��0.1 L��2 mol/L��58.5 g/mol=11.7 g��
(3)�ù�������һ�����ʵ���Ũ����Һ��һ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ������ǩ��������ȷ�IJ�������Ϊ���٢ۢݢڢ���
(4)���ʵ�������ȱ�ٲ�����������ɲ���������ģ����ʵ����ʵ���ƫС��������Һ�����ʵ���Ũ�� ƫ�͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤���������������ʵ�ǣ�������
A. �����ˮ�������������
B. 1molL��1�Ĵ���ˮ��Һ��ʹ��ɫʯ����Һ���ɫ
C. ��������̼������Һ��Ӧ����CO2����
D. ������Һ�д��ڴ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(12��) ijʵ��С������ͼװ�ý����Ҵ���������ʵ�顣Z.X.X.K]
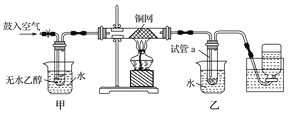
(1)ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д����Ӧ�Ļ�ѧ��Ӧ����ʽ ��
�ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ�������Ӧ�� ��Ӧ�����Ȼ����ȣ���
(2)��������ˮԡ���ò���ͬ���������� ��
�ҵ������� ��
(3)��Ӧ����һ��ʱ������Թ�a�����ռ�����ͬ�����ʣ������� ,
����ƿ���ռ������������Ҫ�ɷ��� ��
(4)���Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л����� ��Ҫ��ȥ�����ʣ������ڻ��Һ�м��� (��д��ĸ)��Ȼ����ͨ�� (��ʵ���������)���ɳ�ȥ��
a���Ȼ�����Һ b���� c��̼��������Һ d�����Ȼ�̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ϢϢ��ء�����������ȷ���ǣ� ��
A. ��ʳƷ�������յ���
B. �þ�����ϩ���ϱ�Ĥ��װʳƷ
C. ʳ�ú����ḻ��ʳ����Բ�����
D. ��̼�ᱵ��ҽ���ϵġ����͡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���⣺
��1������˵����ȷ����_________
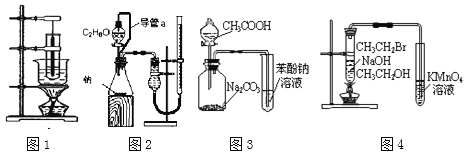
A��ͼ1Ϊʵ�����Ʊ���������װ��
B��ͼ2�������ڲⶨ�Ҵ����ӽṹ
C��ͼ3װ�ÿ��Դﵽ��֤���ԣ�CH3COOH > H2CO3 > C6H5OH��Ŀ��
D��ͼ4װ�ÿ��Դﵽ��֤�����鷢����ȥ��Ӧ����ϩ����Ŀ��
(2)��������ԭ�ζ����ⶨ�Ʊ��õ���TiO2�����е�TiO2��������������һ�������£���TiO2�ܽⲢ��ԭΪTi3+������KSCN��Һ��Ϊָʾ������NH4Fe(SO4)2����Һ�ζ�Ti3+��ȫ������Ti4+��
��TiCl4ˮ������TiO2��xH2O�Ļ�ѧ����ʽΪ____________________��
�ڵζ��յ��������___________________��
�۵ζ�����ʱ����ȡTiO2����0.2 g������0.1 mol��L��1NH4Fe(SO4)2����Һ20mL����TiO2����������Ϊ________________��
�����ڵζ��յ��ȡ�ζ��̶ܿ�ʱ�����ӱ���Һ��Һ�棬ʹ��ⶨ���__________(�ƫ��ƫС������Ӱ�족)��
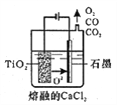
�ݹ�ҵ����H4TiO4���Ƶ��Ѱ�TiO2��TiO2ֱ�ӵ�ԭ����������һ�ֽ��Ƚ��ķ����������Ϊ���ڵ�CaCl2��ԭ����ͼ��ʾ�������ĵ缫��ӦΪ_________��
(3)�ڻ�ѧ�����в���K2CrO4Ϊָʾ��,��AgNO3����Һ�ζ���Һ��Cl-,����Ag+��Cr![]() ����ש��ɫ����,ָʾ����ζ��յ㡣����Һ��Cl-ǡ�ó�����ȫ(Ũ�ȵ���1.0��10-5 mol��L-1)ʱ,��Һ��c(Ag+)Ϊ______mol��L-1,��ʱ��Һ��c(Cr
����ש��ɫ����,ָʾ����ζ��յ㡣����Һ��Cl-ǡ�ó�����ȫ(Ũ�ȵ���1.0��10-5 mol��L-1)ʱ,��Һ��c(Ag+)Ϊ______mol��L-1,��ʱ��Һ��c(Cr![]() )����_______mol��L-1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��10-12��2.0��10-10)
)����_______mol��L-1��(��֪Ag2CrO4��AgCl��Ksp�ֱ�Ϊ2.0��10-12��2.0��10-10)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������λ������( )
��N2H5+ ��CH4 ��OH�� ��NH4+ ��Fe(CO)3 ��Fe(SCN)3 ��H3O�� ��[Ag(NH3)2]OH
A���٢ܢޢߢ� B���ۢܢݢޢ� C���٢ܢݢޢߢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��N��E��G����ԭ������С��36��Ԫ�أ�XZ2����������ЧӦ����Ҫ���壬Z��Mͬ������M�����������ǵ��Ӳ�����2����YԪ�صĻ�̬ԭ���������3��δ�ɶԵ��ӣ��������2�����ӡ�N2+����3d��9�����ӣ�E�� G�����ڱ��мȴ���ͬһ����Ҳ����ͬһ�壬��ԭ������E��GС2����ش��������⣺�����л�ѧʽ����Ԫ�ط��ű�ʾ��
��1��д��G����Χ�����Ų�ʽ________��X��Y��Z�ĵ縺������Ϊ___________
��2��XZ32��������ԭ���ӻ���ʽΪ_____________��
��3���Ƚ�Z���⻯��(H2Z)��M���⻯�H2M�����ȶ���ǿ������������ԭ����____________��
��4��N��Y���γɵ�һ�־������õĵ�ѧ��ѧ���ܵĻ�����侧���ṹ����ͼ��ʾ����û�����Ļ�ѧʽΪ__________��

��5�������������仯ʾ��ͼ����д��YZ��XZ2��Ӧ���Ȼ�ѧ����ʽ ______________��

��6���������E���ӿɲ��õķ���Ϊ���ں����������ӵ���Һ�м���ij���Լ�������������ɫ���������Ӧ�����ӷ���ʽ��______________����E��һ�������¿��γ����������ѻ��ľ���,��Eԭ�Ӱ뾶Ϊr,���ú�r�Ĵ���ʽ��ʾ�þ���ռ�������_______________.�����ػ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�AlCl3��MgCl2��MgSO4��Al2��SO4��3������������ˮ���γɵĻ����Һ��c��Al3������0.1mol��L��1��c��Mg2������0.25mol��L��1��c��Cl������0.2mol��L��1�������Һ��c��SO42����Ϊ
A. 0.15mol��L��1
B. 0.20mol��L��1
C. 0.25mol��L��1
D. 0.30mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������������泥�NH2COONH4�������ܱ������У�������ӦNH2COONH4 (s)![]() 2NH3 (g)+ CO2 (g) ���÷�Ӧ��ƽ�ⳣ���ĸ�������-lgK��ֵ���¶ȣ�T���ı仯������ͼ��ʾ������˵���������
2NH3 (g)+ CO2 (g) ���÷�Ӧ��ƽ�ⳣ���ĸ�������-lgK��ֵ���¶ȣ�T���ı仯������ͼ��ʾ������˵���������
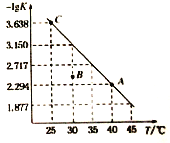
A. C���Ӧ״̬��ƽ�ⳣ��K(C)=10-3.638
B. �÷�Ӧ�ġ�H>0
C. NH3�������������ʱ���÷�Ӧһ���ﵽƽ��״̬
D. 30 ��ʱ��B���Ӧ״̬��v(��)��v(��)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com