
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s) +3B(g)![]() 2C(g)+D(g)已达平衡状态的是(其中只有B气体有颜色)
2C(g)+D(g)已达平衡状态的是(其中只有B气体有颜色)
A.混合气体的压强
B.混合气体的密度
C.气体的平均分子量
D.气体的颜色
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的气、固混合物在氧气中完全燃烧,共放出63.53 kJ热量,则炭粉与氢气的物质的量之比为( )
A. 2∶3 B. 1∶2 C. 1∶1 D. 3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应中,平衡常数与反应进行的限度关系正确的是( )
A.K越大,反应程度越大 B.K越大,反应程度越小
C.K的大小与反应程度无关 D.升高温度,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 |
(4)判断K+是否存在,若存在求其最小浓度(若不存在说明理由) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列常见物质的俗名与化学式对应正确的是
A. 小苏打— NaHCO3 B. 铁红— Fe3O4
C. 熟石灰— CaO D. 明矾— CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙醛(CH3CHO)和新制氢氧化铜的反应如下:
CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
某实验小组做上述反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 的现象 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2 mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1 mL | 1 mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2 mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1 mL | 3 mL | 蓝紫色溶液 | 12~13 | ———— |
(1)上表中a、b应为 (填字母序号)。
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4反应的化学方程式 。基于实验1、2的现象可以得出结论:NaOH用量较少时, 。
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其理论依据是 。
(4)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是 。
(5)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4] 2-),由此提出问题:[Cu(OH)4] 2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是 。基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.雷雨天气时空气中能生成少量的氮氧化物
B.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
C.铵盐化学性质都很稳定
D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物有着广泛用途。工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下:
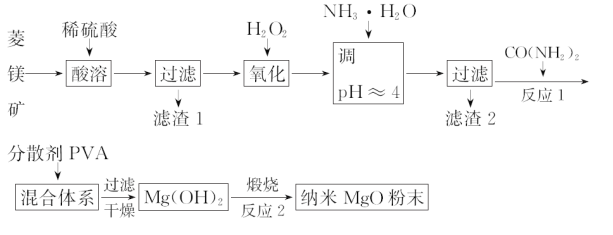
(1)滤渣1为______________________。
(2)加入H2O2氧化时,发生反应的离子方程式为______________________。
(3)在实验室煅烧滤渣2制得的金属氧化物为____________(填化学式),需要的仪器除酒精灯、三脚架、泥三角以外,还需要______________(填名称)。
(4)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,该反应中反应物的质量之比为________。
(5)25℃时,加入CO(NH2)2至开始产生沉淀,当Mg2+全部沉淀时溶液的c(OH-)=__________(已知25℃,Ksp[Mg(OH)2]=1.96×10-11)。
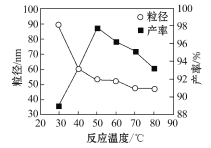
(6)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制备 纳米MgO。取少量制得的该物质溶于某种液体溶剂中(两者不反应),能说明是纳米MgO存在的简单方法是____________。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
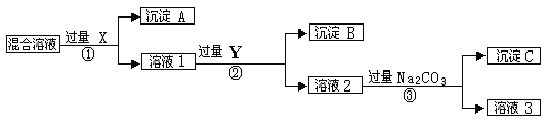
请回答下列问题:
(1)写出实验流程中下列物质的化学式。试剂X : ,沉淀A: ,试剂Y: ,沉淀B: 。
(2)上述实验流程中加入过量的Na2CO3的目的是 。
(3)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com