
 (1)科学家正在研究温室气体CH4和CO2的转化和利用.
(1)科学家正在研究温室气体CH4和CO2的转化和利用.分析 (1)①元素的非金属性越强,其电负性越大;
②依据二氧化碳和甲烷的结构以及性质回答;
③a.Ni为28号元素;
b.该配合物的配离子中Ni原子和C原子、CO分子中C原子和O原子之间都存在σ键;
(2)①乙醛中甲基上的C采取sp3杂化类型,醛基中的C采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键;乙酸分子间可形成氢键导致沸点较高;
②在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占$\frac{1}{2}$,通过一个顶点可形成8个晶胞;
③a.Cu+核外有28个电子,Cu原子失去1个电子生成Cu+,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式;
b.原子个数相等、价电子数相等的微粒互为等电子体,等电子体的结构相似;
c.铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×$\frac{1}{2}$.
解答 解:(1)①元素的非金属性越强,其电负性越大,由于非金属性O>C>H,故电负性H<C<O;
故答案为:H<C<O;
②a、二氧化碳属于分子晶体,故a正确;
b、甲烷中含有极性共价键,但是正四面体结构,属于非极性分子,故b错误;
c、二氧化碳熔点高,原因是C与O形成2对共价键,故c错误;
d、甲烷为正四面体形,C原子含有4个σ键,无孤电子对,采取sp3杂化,二氧化碳为直线形,碳氧双键中有1个σ键和1个π键,因此C原子采取sp杂化,故d正确,
故答案为:ad;
③a.Ni为28号元素,基态Ni原子的电子排布式为[Ar]3d84s2,处于元素周期表中第四周期第VⅢ族,故答案为:[Ar]3d84s2;VⅢ;
b.该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键,故答案为:8;
(2)①乙醛中甲基上的C形成4条σ键,无孤电子对,因此采取sp3杂化类型,醛基中的C形成3条σ键和1条π键,无孤电子对,采取sp2杂化类型;1个乙醛分子含有6个σ键和一个π键,则1mol乙醛含有6molσ键,即6NA个σ键;乙酸分子间可形成氢键,乙醛不能形成氢键,所以乙酸的沸点高于乙醛;
故答案为:sp3、sp2;6NA;CH3COOH的相对分子质量大于乙醛并且醋酸存在分子间氢键;
②在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,面心占$\frac{1}{2}$,通过一个顶点可形成8个晶胞,因此该晶胞中铝原子的配位数为8×3×$\frac{1}{2}$=12;一个晶胞中Al原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,因此Al的密度ρ=$\frac{m}{V}$=$\frac{4×27}{{N}_{A}×(0.405×1{0}^{-7})^{3}}$g•cm-3,
故答案为:12;$\frac{4×27}{{N}_{A}×(0.405×1{0}^{-7})^{3}}$;
③a.Cu+核外有28个电子,Cu原子失去1个电子生成Cu+,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,故答案为:1s22s22p63s23p63d10或[Ar]3d10 ;
b.原子个数相等、价电子数相等的微粒互为等电子体,与OH-互为等电子体的一种分子为HF,
故答案为:HF;
c.铜晶体中每个铜原子周围距离最近的铜原子数目=3×8×$\frac{1}{2}$=12,
故答案为:12.
点评 本题考查晶胞计算等,涉及晶体的性质、原子核外电子排布规律、共价键类型、氢键、杂化类型、配位数及密度的计算,综合性非常强,题目难度中等,其中晶胞配位数以及密度的计算是本题的难点.


科目:高中化学 来源: 题型:选择题
| A. | 等质量的NaHCO3和Na2CO3与足量盐酸反应,在相同条件下NaHCO3产生的CO2体积大 | |
| B. | 等物质的量的两种盐与同浓度盐酸完全反应,所消耗盐酸的体积Na2CO3是NaHCO3的两倍 | |
| C. | 将石灰水加入NaHCO3溶液中无沉淀,加入Na2CO3溶液中有白色沉淀 | |
| D. | 等浓度的两种盐溶液分别与等浓度的盐酸反应,碳酸氢钠溶液的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
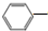 CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$
CH2CH3(g)+Cl2(g)$\stackrel{催化剂}{?}$ CHCl-CH3(g)+HCl(g)△H>0
CHCl-CH3(g)+HCl(g)△H>0| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
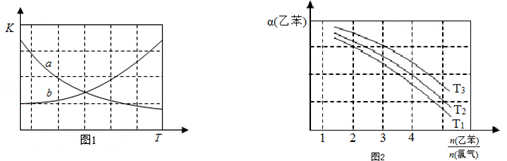
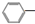 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)△H=+124kJ/mol
CH=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验探究 | 实验操作及现象 | 结论分析 |
| 探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化. ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加KSCN溶液溶液,变成血红色. | 证明淡蓝绿色粉末为FeSO4 |
| 探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象. | 证明:红色物质不是Fe2O3. |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com