
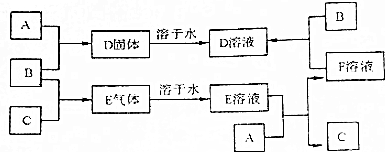
分析 A、B、C为中学化学中常见的单质,室温下,A为固体,B和C均为气体.结合图中转化可知,A为固体,常见为碳、钠、镁、铝、铁等,B、C为气体单质,常见有氯气、氧气、氢气、氮气等,固体A和气体B反应生成的D是固体,说明A为金属不为碳,E溶液能与金属反应,且E是两种气体反应所得产物,则E应为酸,C应为H2,所以B为Cl2,E为HCl,D为金属和盐酸反应生成的氯化物盐,此盐可以直接由A和Cl2反应得到,B与F溶液反应生成D,说明A为变价金属铁,F为FeCl2,D为FeCl3,以此来解答.
解答 解:A、B、C为中学化学中常见的单质,室温下,A为固体,B和C均为气体.结合图中转化可知,A为固体,常见为碳、钠、镁、铝、铁等,B、C为气体单质,常见有氯气、氧气、氢气、氮气等,固体A和气体B反应生成的D是固体,说明A为金属不为碳,E溶液能与金属反应,且E是两种气体反应所得产物,则E应为酸,C应为H2,所以B为Cl2,E为HCl,D为金属和盐酸反应生成的氯化物盐,此盐可以直接由A和Cl2反应得到,B与F溶液反应生成D,说明A为变价金属铁,F为FeCl2,D为FeCl3,
(1)A所属元素类别为金属,故答案为:金属;
(2)B、C的化学式分别为Cl2、H2,故答案为:Cl2;H2;
(3)B与F溶液反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-,故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(4)若将F溶液在空气中蒸干、灼烧,水解生成的HCl易挥发,氢氧化铁分解生成氧化铁,所得固体的化学式为Fe2O3,故答案为:Fe2O3.
点评 本题考查无机物的推断,为高频考点,把握铁及其化合物的性质、相互转化为解答的关键,侧重分析与推断能力的考查,注意B为氯气、A为Fe为推断的突破口,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加水,将湿润的红色石蕊试纸放在试管口 | |
| C. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 | |
| B. | 乙醇依次通过消去、取代、加成反应可生成乙二醇 | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
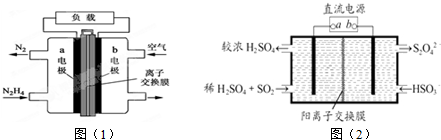
| A. | 图(1)中的a电极应与 图(2)的a相连 | |
| B. | 图(1)中a电极应的反应方程式为:N2H4+4OH--4e-═N2+4H2O | |
| C. | 用该燃料电池作为装置图(2)的直流电,吸收1 molSO2至少需要通人 0.5 mol N2H4 | |
| D. | 图(1)中OH-由阴离子交换膜从左流向右,图(2)中H+由阳离子交换膜从右流向左 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
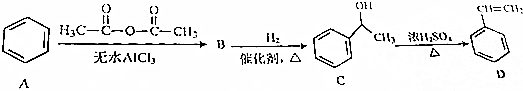
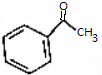 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ/mol) | 497 | 803 | 1072 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8是折线形极性分子 | |
| B. | 只有过渡金属才能接受电子对形成配合物 | |
| C. | 乳酸[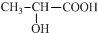 ]中存在一个手性碳原子 ]中存在一个手性碳原子 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子,而HClO中非羟基氧原子个数为0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com