
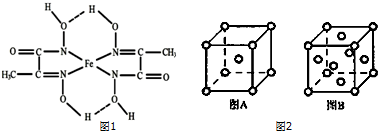
分析 (1)Fe原子的电子排布式是1s22s22p63s23p63d64s2,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素的3d轨道电子数为1、2、3、5、10;
(2)A.3p能级有3个轨道,最多容纳6个电子;
B.黑色金属包括铁、铬、锰,d区元素包括ⅢB~ⅦB、Ⅷ族元素;
C.铁的焰色反应焰色反应发出的光不影响其它金属火焰颜色;
D.Fe(CO)5分子含有5个配位键,而CO分子中含有1个σ键;
(3)①非金属性越强,元素的电负性越大;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4;
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外N原子带1个单位负电荷,与亚铁离子之间形成离子键;
(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力;
(5)根据均摊法计算晶胞中Fe原子数目,可以计算晶胞质量之比,图A体心立方密堆积,晶胞棱长长度为$\frac{4r}{\sqrt{3}}$cm,图B为面心立方密堆积,晶胞棱长长度为$\frac{\sqrt{2}}{2}$×4r=2$\sqrt{2}$rcm,结合ρ=$\frac{m}{V}$计算.
解答 解:(1)Fe原子的电子排布式是1s22s22p63s23p63d64s2,电子占据最高的能层的符号为N,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素的3d轨道电子数为1、2、3、5、10,还有5种,
故答案为:N;5;
(2)A.3p能级有3个轨道,最多容纳6个电子,选项中排列违反了泡利原理,故A正确;
B.黑色金属包括铁、铬、锰,d区元素包括ⅢB~ⅦB、Ⅷ族元素,故B正确;
C.铁的焰色反应焰色反应发出的光不影响其它金属火焰颜色,故C错误
D.Fe(CO)5分子含有5个配位键,而CO分子中含有1个σ键,1molFe(CO)5中含有的σ键数是6NA,故D错误,
故选:AB;
(3)①非金属性越强,元素的电负性越大,则电负性O>N>C>H>Fe,
故答案为:O>N>C>H>Fe;
②化合物中形成C=N双键的N原子形成2个σ键,含有1对孤电子对,而形成单键的N原子,形成2个σ键,含有2对孤电子对,杂化轨道数目分别为3、4,N原子采取sp2、sp3杂化,
故答案为:sp2、sp3;
③C=N双键的N原子有1对孤对电子与亚铁离子之间形成配位键,另外N原子带1个单位负电荷,与亚铁离子之间形成离子键,标出亚铁离子的配位键为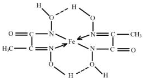 ,
,
故答案为: ;
;
(4)异硫氰酸中 H-N 键极性强,分子间存在氢键,而硫氰酸分子间只存在分子间作用力,所以异硫氰酸的沸点高于硫氰酸,
故答案为:异硫氰酸或H-N=C=S;
(5)图A体心立方密堆积,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,晶胞棱长长度为$\frac{4r}{\sqrt{3}}$cm,图B为面心立方密堆积,晶胞中Fe原子数目为8×$\frac{1}{8}$$+6×\frac{1}{2}$=4,晶胞棱长长度为$\frac{\sqrt{2}}{2}$×4r=2$\sqrt{2}$rcm,晶胞质量之比为2:4=1:2,则A、B两种晶体密度之比是$\frac{1}{(\frac{4r}{\sqrt{3}})^{3}}$:$\frac{2}{(2\sqrt{2})^{3}}$=$\frac{3\sqrt{6}}{8}$,
故答案为:$\frac{3\sqrt{6}}{8}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式、配合物、氢键、晶胞计算等,(3)中配位键判断为易错点,(5)中掌握均摊法进行晶胞计算,需要一定的数学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
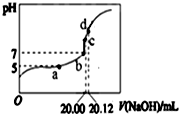 常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | a点所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | d点所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始滴加氨水后溶液导电能力逐渐增强,说明HR为弱酸 | |
| B. | 滴入10mL氨水后酸碱恰好中和,此时溶液pH=7 | |
| C. | 随若氨水的加入,当c(OH-)>c(H+)时,c(NH4+)>(R-) | |
| D. | 该过程中溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
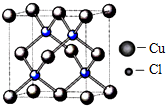 碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.
碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丁>丙>乙 | |
| B. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| C. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 | |
| D. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
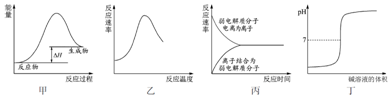
| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示强碱滴定强酸的滴定曲线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com