
| A.c(CH3COOH)=0.01mol·L-1 |
| B.c(H+)=c(CH3COO-) |
| C.加水稀释100倍后,溶液pH=4 |
| D.醋酸的电离常数为Ka,CH3COO-的水解常数为Kh,则Ka·Kh=Kw |
 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源:不详 题型:实验题
 I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度  I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
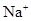 )>c(
)>c(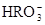 )>c(
)>c(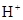 )>c(
)>c(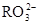 )>c(
)>c(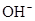 )
)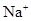 )+c(
)+c(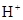 )=c(
)=c(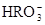 )+2c(
)+2c(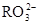 )+c(
)+c(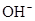 )
)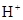 )+c(
)+c(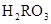 )=c(
)=c(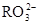 )+c(
)+c(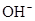 )
)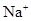 )、c(
)、c(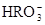 )、c(
)、c(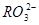 )分别相等
)分别相等查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.鼓励汽车、家电“以旧换新”,可提高能源利用效率,与环境保护基本无关系 |
| B.农村大力发展沼气,将废弃的秸秆转化为清洁高效的能源 |
| C.镁铝合金可用作制造飞机的材料 |
| D.氢氧燃料电池要广泛地应用于实际生产、生活中,高容量储氢材料的研制是需解决 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该硝酸中水电离出的c(H+)=1.0×10-3mol/L |
| B.加水稀释到原溶液体积的100倍,硝酸溶液的pH为5 |
| C.相同温度下,pH=3的CH3COOH溶液的物质的量浓度与该硝酸相同 |
| D.该硝酸中加入少量的Zn粒产生H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合前CH3COONa溶液中由水电离出来的c(OH—)>1×10-7 mol·L-1 |
| B.混合前NaCl溶液中:c(Na+) + c(OH—)= c(Cl-)+c(H+) |
| C.混合溶液中 :c(Cl-) >c(CH3COOH) >c(OH—) |
| D.混合溶液中:c(Cl-) + c(CH3COO-) =0.1mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-488.3 kJ/mol | B.+488.3 kJ/mol |
| C.-191 kJ/mol | D.+191 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com