
| A. | 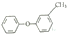 的同分异构体中,有醇、酚、酯类物质 的同分异构体中,有醇、酚、酯类物质 | |
| B. | 1mol 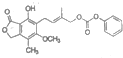 最多能与含5.0molNaOH的水溶液完全反应 最多能与含5.0molNaOH的水溶液完全反应 | |
| C. | 纯净物C4H8的氢种类最多为3种 | |
| D. | 化学式为C8H8的有机物,一定能和溴水发生加成反应 |
分析 A.该物质中只含一个O元素,所以不可能形成酯基;
B.该物质中能和NaOH反应的有酯基水解生成的羧基和酚羟基及该物质中的酚羟基反应;
C.该物质可能是环丁烷、1-丁烯、2-丁烯、2-甲基丙烯;
D.该有机物如果是立方烷,则不能和溴反应.
解答 解:A.该物质中只含一个O元素,所以不可能形成酯基,则该分子的同分异构体中不能有酯,故A错误;
B.该物质中能和NaOH反应的有酯基水解生成的羧基和酚羟基及该物质中的酚羟基反应,该物质中含有1个酚羟基、两个酯基,且右边的酯基水解生成酚羟基和碳酸,所以1mol  最多能与含5.0molNaOH的水溶液完全反应,故B正确;
最多能与含5.0molNaOH的水溶液完全反应,故B正确;
C.该物质可能是环丁烷、1-丁烯、2-丁烯、2-甲基丙烯,纯净物C4H8的氢种类最多为4种,最少为1种,故C错误;
D.该有机物如果是立方烷,没有碳碳不饱和键,则不能和溴反应,故D错误;
故选B.
点评 本题考查有机物结构和性质及同分异构判断,为高频考点,明确官能团及其性质关系是解本题关键,易错选项是BD,注意B中右边酯基水解生成碳酸而不是一元羧酸,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②⑤⑥ | C. | ②⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸存放在带有橡胶塞的棕色玻璃瓶中 | |
| B. | 溴水存放在带橡胶塞的试剂瓶中 | |
| C. | 浓硝酸保存在磨口玻璃塞棕色试剂瓶中,并置于阴凉处 | |
| D. | 氢氧化钠溶液保存在磨口玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、Cl2、N2、酸雨 | B. | SO2、NO2、可吸入颗粒物 | ||
| C. | NH3、CO2、NO2、雾 | D. | HCl、SO2、N2、可吸入颗粒物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
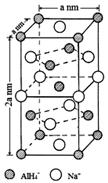 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键). 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,将浓度均为0.10mol.L-1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$]随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )
常温下,将浓度均为0.10mol.L-1、体积均为V0L的HX溶液和HY溶液分别加水稀释至体积为VL,其AG[AG=lg$\frac{c{(H}^{+})}{c{(OH}^{-})}$]随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述错误的是( )| A. | HX的酸性强于HY的酸性 | |
| B. | a点的c(Y-)与b点的c(X-)相等 | |
| C. | 水的电离程度:a点小于c点 | |
| D. | 若两溶液同时升高温度,则c(Y-)和c(X-)均增大 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )
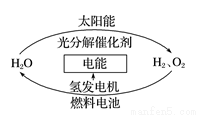
A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D.氢气不易贮存和运输,无开发利用价值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com