
| A、1S22S22p63S23p64S14p5 |
| B、1S22S22p63S23p63d6 |
| C、1S22S22p63S23p64S23d4 |
| D、1S22S22p63S23P63d54S1 |


科目:高中化学 来源: 题型:
| A、所有的电子在同一区域里运动 |
| B、能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动 |
| C、处于最低能量的原子叫基态原子 |
| D、同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
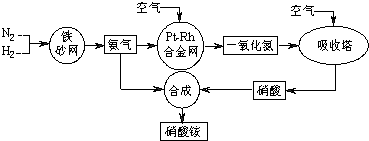
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、肯定有Al3+、SO42-,可能有K+、NH4+ |
| B、肯定无Fe2+、Mg2+、CO32-,可能有Al3+ |
| C、原溶液一定是明矾和MgSO4的混合溶液 |
| D、不能确定的离子只能通过焰色反应来确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com