
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B、向氢氧化钠溶液中通入少量CO2:CO2+OH-=HCO3- |
| C、铝片放入NaOH溶液中:2OH-+Al=AlO2-+H2↑ |
| D、往碳酸钙中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
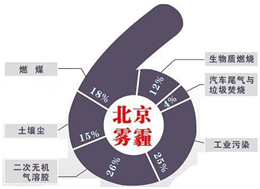 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.
| ||
| ||
| 催化剂 |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质(25℃) | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | ≥6.4 | ≥9.6 | ≥3~4 |
A、混合溶液中:c(SO
| ||
| B、若向混合溶液中加入铁粉,不可能观察到红色固体析出 | ||
| C、若向混合溶液中加入足量氯水,调节pH到3-4后过滤,得到纯净的CuSO4溶液 | ||
| D、若向混合溶液中逐滴加入烧碱溶液,首先生成Fe(0H)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用两个铜电极电解饱和食盐水:2Cl-+2H2O
| ||||
| B、AgCl悬浊液中加入硫化钠饱和溶液:2AgCl+S2-=Ag2S+2Cl- | ||||
| C、氢氧化镁与稀硫酸反应:H++OH-=H2O | ||||
D、向20mL沸水中滴入1mL饱和FeCl3溶液,继续煮沸至溶液呈红褐色:Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 测量一定时间内生成H2的反应速率 |
B、 用CO2做喷泉实验 |
C、 除去Cl2中的少量HCl |
D、 比较Na2CO3与NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、②⑤ | B、③⑤ |
| C、②③④ | D、①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水的阳极反应:2H2O+2e-=H2↑+2OH- | ||
B、碳酸钠溶液呈碱性的原因:CO
| ||
C、向AgNO3溶液中加入过量氨水:Ag++NH3?H2O=AgOH↓+NH
| ||
D、泡沫灭火器反应原理:A12++3HCO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产.
草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com