
【题目】电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液电导率如图所示。下列说法不正确的是( )
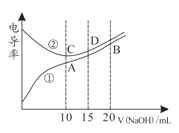
A.曲线①代表滴定CH3COOH溶液的曲线
B.在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C
C.D点溶液中:c(Cl-)=2c(OH-)-2c(H+)
D.A点溶液中:c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1
【答案】B
【解析】
试题分析:溶液导电能力与离子浓度成正比,CH3COOH是弱电解质,溶液中离子浓度较小,加入KOH后,溶液中离子浓度增大,溶液导电性增强;HCl是强电解质,随着KOH溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应式离子浓度最小,继续加入KOH溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线②代表0.1 mol/L NaOH溶液滴定HC1溶液的滴定曲线,曲线①代表0.1 mol/LKOH溶液滴定CH3COOH溶液的滴定曲线;A.由分析可知,曲线①代表滴定CH3COOH溶液的曲线,故A正确;B.酸或碱抑制水电离,含有弱离子的盐促进水电离,C点溶质为NaCl,A点溶质为醋酸钠,促进水电离,B点为等物质的量浓度的醋酸钠和NaOH,NaOH会抑制水的电离,所以在相同温度下,水电离的c(H+):B<C<A,故B错误;C.D点溶液中,c(Na+)=1.5c(Cl-),溶液中电荷守恒为c(Cl-)+c(OH-)=c(Na+)+c(H+),则c(Cl-)=2c(OH-)-2c(H+),故C正确;D.A点溶液中c(Na+)=0.05mol/L,电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)-c(H+)=c(Na+)=0.05mol/L,故D正确;故选B。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.2mol的铁与足量的稀硝酸反应,生成气体的分子效目为0.3NA
B. 常温常压下,14g由C2H4、C3H6组成的混合气体中含有碳原子的数目为NA
C. 2.24LCO2与足量的Na2O2反应.转移的电子总数必为0.1NA
D. 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和乙烷的说法中,不正确的是( )
A. 乙烯属于不饱和链烃,乙烷属于饱和链烃
B. 乙烯分子中所有原子处于同一平面上,乙烷分子中的原子不在同一平面上
C. 乙烯分子中的 双键比乙烷分子中的 C—C 单键更稳定,性质更活泼
D. 乙烯能使酸性 KMnO4 溶液褪色,乙烷不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物或结构的组成中,其元素组成不相同的是
A. 白细胞介素、胰岛素、生长激素 B. 核糖体、染色体、目的基因的运载体
C. 脂肪酸、丙酮酸、核苷酸 D. 抗体、膜上载体、蛋白酶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水和无机盐的叙述,不正确的是
A. 极性分子或离子易溶于水,水是生物体内物质运输的良好介质
B. 多细胞生物体的绝大多数細胞,必须浸润在以水为基础的液体环境中
C. 无机盐在生物体内含量不高,多数以离子形式存在
D. 维持血浆的正常浓度、酸碱平衡等需要保持恒定的无机盐浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是( )
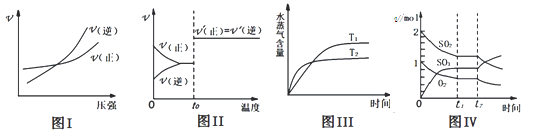
A.图 I:反应 N2(g)+3H2(g) ![]() 2NH3(g)在恒温情况下,反应速率与压强的关系
2NH3(g)在恒温情况下,反应速率与压强的关系
B.图Ⅱ:反应 H2(g)+I2 (g) ![]() 2HI(g)达平衡后,升高温度时反应速率随时间变化
2HI(g)达平衡后,升高温度时反应速率随时间变化
C.图Ⅲ:反应 CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0,水蒸气含量随时间变化
CO(g)+H2O(g) ΔH>0,水蒸气含量随时间变化
D.图Ⅳ:反应 2SO2(g)+O2(g) ![]() 2SO3(g)达平衡后,缩小容器体积各成分物质的量随时间变化
2SO3(g)达平衡后,缩小容器体积各成分物质的量随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 聚乙烯是无毒高分子化合物,可用作食品包装
B. 醋和蔗糖的主要成分均为有机物
C. 蜜蜂蜇人将蚁酸注入人体可涂抹肥皂缓解
D. 人造纤维、合成纤维和光导纤维都是有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化铜、氯化铝、氯化亚铁、氯化铁、氯化镁五种无色溶液,通过一种试剂就能鉴别,这种试剂是( )
A.KSCN
B.BaCl2
C.HCl
D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合碱式碳酸镁[4MgC03·Mg(OH)2·4H2O〕,又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90% ,碳酸钙10%〕碳化法制取:
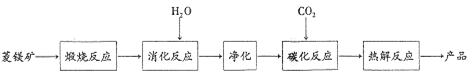
(1)根据下列表格数据,选择消化反应的最佳温度_____;理由是__________。

(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为_______。
(3)流程图中______和_____可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5时,可以认为完全除去。常温时当调节溶液pH为9.5时,此时Mn2+小于_____mol/L,不会沉淀出来。

②如果把Fe2+转化为Fe3+,从环境角度选择最合适的氧化剂为______。
A. Ca(C10)2 B. Cl2 C. H202 D. HNO3
③下列方案中,较好的为_______,理由是___________。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com