
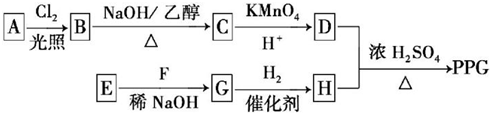
 .
. .
. ,反应类型为消去反应.
,反应类型为消去反应. .
. (写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).
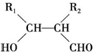
(写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).分析 烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为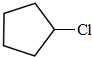 ,B发生消去反应生成C为
,B发生消去反应生成C为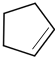 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(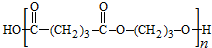 ),据此分析解答.
),据此分析解答.
解答 解:烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(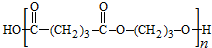 ),
),
(1)由上述分析可知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)由B生成C的化学方程式为: ,为消去反应,
,为消去反应,
故答案为: ;消去反应;
;消去反应;
(3)由E和F生成G的反应类型为加成反应,故答案为:加成反应;
(4)①由D和H生成PPG的化学方程式为: ,
,
故答案为: ;
;
②若PPG平均相对分子质量为10000,则其平均聚合度约为$\frac{10000}{12×8+16×4+1×12}$≈58,故答案为:b;
(5)D的同分异构体中能同时满足①能与饱和NaHCO3溶液反应产生气体,含-COOH,②既能发生银镜反应,又能发生水解反应-COOCH,D中共5个C,则含3个C-C-C上的2个H被-COOH、-OOCH取代,共为3+2=5种,含其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 ,D及同分异构体中组成相同,由元素分析仪显示的信号(或数据)完全相同,故答案为:5;
,D及同分异构体中组成相同,由元素分析仪显示的信号(或数据)完全相同,故答案为:5; ;c.
;c.
点评 本题考查有机物的推断,为高考常见题型,把握合成中碳链变化、官能团变化及反应条件推断物质为解答的关键,侧重分析与推断能力的综合考查,熟悉常见有机反应类型及有机物官能团及其性质关系,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 mol/L | B. | 3 mol/L | C. | 2.25mol/L | D. | 1.13 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②③⑤ | C. | ③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中,乙硫醇比乙醇更难电离出H+离子 | |
| B. | 乙硫醇在空气中燃烧生成二氧化碳、三氧化硫和水 | |
| C. | 甲硫醇、乙硫醇与丁硫醇互为同系物 | |
| D. | 沸点不同的丁硫醇有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为16g的O2和O3的混合气体中所含的氧原子的个数为NA | |
| B. | 18 g NH4+含有质子数为10NA | |
| C. | 1 mol过氧化钠与足量水反应时,转移电子的数目为2NA | |
| D. | 0.1 mol•L-1的NaCl溶液中,Na+与Cl-的离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3 | B. | KCl | C. | CO(NH2)2 | D. | KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
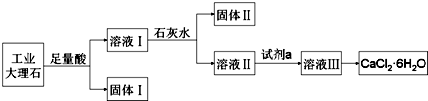
| A. | 固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为AlO2- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O产品的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com