
中国古代四大发明之——黑火药,它的爆炸反应为:
________KNO3+________C+________S-________K2S+________N2↑+________CO2↑(未配平)
(1)请配平上述化学反应方程式,该反应中的氧化剂是________.
(2)除S外,上述反应中所涉及元素的电负性从大到小依次为________.
(3)在生成物中,K2S的晶体类型为________.
(4)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________.
科目:高中化学 来源: 题型:
| ||
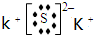

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
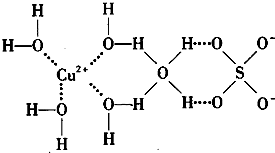 (1)中国古代四大发明之一--黑火药,它的爆炸反应为:2KNO3+3C+S
(1)中国古代四大发明之一--黑火药,它的爆炸反应为:2KNO3+3C+S
| ||
. |
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为___________,Q2+的未成对电子数是_________________ 。
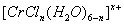 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:  Rx[CrCl3(H2O)6-n]x+ +xH+
Rx[CrCl3(H2O)6-n]x+ +xH+查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com