
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 容器内n(A2):n(B2):n(AB)=1:1:2
B. 容器内气体的密度不随时间变化
C. 容器内气体的总压强不随时间变化
D. 单位时间内生成2n mol AB,同时生成n mol A2
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:

(1)M电极的材料是________,其电极反应式为:________N的电极名称是________,电极反应式为:________
(2)通入甲烷的铂电极的电极反应式为________.
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为________ L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中常温下A、B单质是气体,C、D单质是固体。
(1)写出四种元素的名称:A___________B____________C___________D___________。
(2)用电子式表示A2B的形成过程: _________________________。
(3)由B、C两元素所形成的原子个数比为1:1的化合物属于__________(填“离子”或“共价”)化合物,写出它与水反应的离子方程式______________________。
(4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为_____________。
(5)A2B和A2D的沸点较高者为______________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如下:
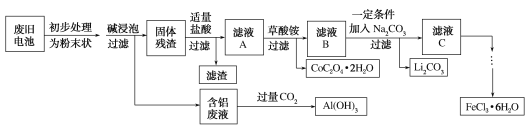
已知:①还原性:Cl->Co2+;
②Fe3+和![]() 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的是________。
(2)从含铝废液得到Al(OH)3的离子方程式为___________
(3)滤液A中的溶质除HCl、LiCl外还有________(填化学式)。写出LiCoO2和盐酸反应的化学方程式____________
(4)滤渣的主要成分为_______(填化学式)。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见下表,请补充完整表中问题。
已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
Ⅰ | 120~220 | CoC2O4·2H2O CoC2O4+2H2O | 19.67% |
Ⅱ | 300~350 | ______ | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02 mol·L-1的Li2SO4和浓度为0.02 mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
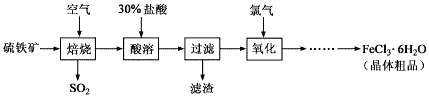
(1)回答下列问题:在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
2SO3(g),该反应的平衡常数表达式为K=______;过量的SO2与NaOH溶液反应生成亚硫酸氢钠,请解释亚硫酸氢钠溶液呈酸性的原因____。
(2)酸溶及后续过程中均需保持盐酸过量,其目的分别是____、_____。
(3)加热FeCl3·6H2O晶体,得到无水FeCl3需在干燥的HCl气流中进行,否则得到的产物为____。
(4)自来水厂同时用氯气和绿矾(FeSO4·7H2O)进行消毒、净化水,其原理是(用离子方程式表示)___________,__________,和Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4燃料电池电解制备Ca(H2PO4)2并得到副产物NaOH、H2、Cl2,装置如图所示。下列说法不正确的是( )
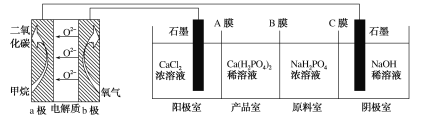
A.a极反应:CH4-8e-+4O2-=CO2+2H2O
B.A膜和C膜均为阴离子交换膜
C.可用铁电极替换阴极的石墨电极
D.a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL 1.0 mol·L-1盐酸溶液和V2mL未知浓度的氢氧化钠溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
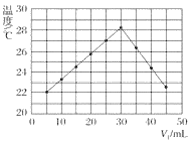
下列叙述正确的是( )
A.做该实验时环境温度为20 ℃
B.该实验表明化学能可能转化为热能
C.氢氧化钠溶液的浓度约为1.0 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①Fe(s)+CO2(g)![]() FeO(s)+CO(g)△H>0
FeO(s)+CO(g)△H>0
反应②Fe(s)+H2O(g)![]() FeO(s)+H2(g)△H<0
FeO(s)+H2(g)△H<0
若反应①在温度T1下进行,反应②在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)
(其他条件均相同),下面对两者反应速率大小判断正确的是( )
A. 反应①快 B. 反应②快 C. 一样大 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院深圳研究院成功研发出一种基于二硫化钼/碳纳米复合材料的钠型双离子电池,可充放电。其放电时工作原理如图所示。下列说法不正确的是( )
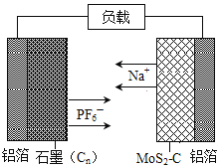
A.二硫化钼/碳纳米复合材料为该电池的负极材料
B.放电时正极的反应式为Cn(PF6)x+xe-═xPF6-+Cn
C.充电时阴极的电极反应式为MoS2-C+xNa++xe-=NaxMoS2-C
D.充电时石墨端铝箔连接外接电源的负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com