
| A. | Br2是氧化剂,NaOH是还原剂 | |
| B. | Br2既是氧化剂又是还原剂 | |
| C. | 被氧化的Br原子和被还原的Br原子的物质的量的比为5:1 | |
| D. | 每生成1mol的NaBrO3转移10mol的电子 |
分析 3Br2+6NaOH═5NaBr+NaBrO3+3H2O反应中,溴元素的化合价由0价变为-1价和+5价,所以Br2既是氧化剂又是还原剂,其中5Br由0价降低到-1被还原,1Br由0价升高到+5被氧化,据此分析.
解答 解:A.该反应中,溴元素的化合价由0价变为-1价和+5价,其它各元素的化合价都不变,所以Br2既是氧化剂又是还原剂,故A错误;
B.根据A知,溴是氧化剂和还原剂,故B正确;
C.5Br由0价降低到-1被还原,1Br由0价升高到+5被氧化,所以被氧化的Br原子和被还原的Br原子的物质的量的比为1:5,故C错误;
D.生成1mol溴酸钠转移电子的物质的量=1mol×(5-0)=5mol,故D错误;
故选B.
点评 本题考查了氧化还原反应,明确元素化合价变化是解本题关键,根据元素化合价来确定氧化剂、还原剂、氧化产物和还原产物,注意转移电子的计算方法,题目难度不大.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| t/K | 300 | 400 | 500 | … |
| K/(mol•L-1)2 | 4×106 | 8×107 | K1 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正反应吸热,m+n>x | B. | 正反应吸热,m+n<x | ||
| C. | 正反应放热,m+n<x | D. | 正反应放热,m+n>x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH与HCl 反应 | B. | CO与O2点燃 | ||
| C. | Ba(OH)2•8H2O与NH4NO3反应 | D. | SO3与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 倭铅是指金属锌和铅的混合物 | B. | 煤炭中起作用的主要成分是C | ||
| C. | 我国历史上铅的使用早于锌 | D. | 该冶炼锌的方法属于热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
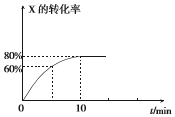 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com