

���� ��1��Ӧ�ȼ��������ԣ��ϳ��ڲ����壬�ټ��ȣ�
��2����װ��G��ĩ���ռ�һС�Թ������ס�ܿڣ��������棬�ɿ���ָ����û�б�������������ž���
��3��������E+F��װ�õ��������ȷ�Ӧǰ������0.7g�������������غ����֪��ϩ����������
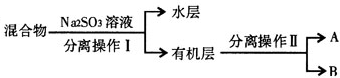
��4�����벻���ܵ�Һ���÷�ҹ�����뻥�ܵ�Һ��������Na2SO3��Һ�������嵥�ʣ�
��� �⣺��1��Ӧ�ȼ��������ԣ��ϳ��ڲ����壬�ٸ�D��Gװ�ü��ȣ�
�ʴ�Ϊ���ڢۢ٣�
��2����װ��G��ĩ���ռ�һС�Թ������ס�ܿڣ��������棬�ɿ���ָ����û�б�������������ž���
�ʴ�Ϊ����K��ʹ����������������װ�ã���װ��G��ĩ���ռ�һС�Թ������ס�ܿڣ��������棬�ɿ���ָ����û�б�������������ž���
��3������E+F��װ�õ��������ȷ�Ӧǰ������0.7g�������������غ����֪��ϩ��������Ϊ0.7g����XΪC2H4��yΪC3H6
28x+42y=0.7g
�ٸ�����ԭ�ӵ��غ��ϵ���£�
2��2x+y��+$\frac{6x+4y}{2}$=$\frac{1.76}{16}$mol
��ã�x=y=0.01mol
�ʴ�Ϊ��1��1��
��4���������������л��ﲻ���ܣ����벻���ܵ�Һ���÷�ҹ�����뻥�ܵ�Һ��������
�ʴ�Ϊ����Һ������
��Na2SO3��Һ�������嵥�ʣ���ȥ���Һ��δ��Ӧ����壬
�ʴ�Ϊ����ȥ���Һ��δ��Ӧ����壮
���� ���⿼��ʵ�������ʵ����㣬���ӷ���ʽ����д�����ʷ�����ᴿ�ķ������ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SiO2��NO2������NaOH��Һ��Ӧ���������������� | |
| B�� | Na2O��Na2O2���Ԫ����ͬ����CO2��Ӧ����Ҳ��ͬ | |
| C�� | Ϊ������ˮ��c��HClO����Ӧ��ȡ�Ĵ�ʩ�Ǽ���CaCO3���� | |
| D�� | ���������������¿�ʢ��Ũ���ᣬ����Ϊ��������������Ũ�����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol�״��к���C-H������ĿΪ4NA | |
| B�� | 12gʯīϩ������ʯī���к�����Ԫ���ĸ���Ϊ0.5NA | |
| C�� | ��״���£�11.2L���к��з��ӵ���ĿΪ0.5NA | |
| D�� | 1mol��ϩ���к���˫������ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Ũ�����жۻ� | |
| B�� | ������ͬ���������ۣ��ֱ���������ϡ���������������Һ��Ӧ������������ǰ�߶� | |
| C�� | �Ͻ���۵�һ���������ĸ��ɷֽ������۵㶼�� | |
| D�� | ��ҵ�ϳ��������ȷ�Ӧұ�����۵Ľ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ı���ģ����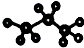 | |
| B�� | C2H4��C3H6һ����Ϊͬϵ�� | |
| C�� | 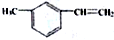 ���ڷ����� ���ڷ����� | |
| D�� | �ǻ��ĵ���ʽΪ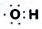 ��1mol-OH����7mol���� ��1mol-OH����7mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ɵij������ﵽ���ʱ������NaOH��Һ�����V��100 mL | |
| B�� | ������ȫ���ܽ�ʱ���μӷ�Ӧ����������ʵ���һ����0.4mol | |
| C�� | �μӷ�Ӧ�Ľ�����������Ϊ9.6 g��m��3.6 g | |
| D�� | ������ȫ���ܽ�ʱ�ռ���NO��������һ��Ϊ2.24 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
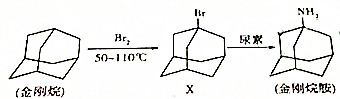
| A�� | ������Dz������� | B�� | ����鰷�ķ���ʽΪC10H16N | ||
| C�� | ������Ӧ������ȡ����Ӧ | D�� | X�����ط�Ӧ����-����������H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǽ����ԣ�F��Cl��S | B�� | �۵㣺I2��H2O��H2S | ||
| C�� | �ȶ��ԣ�HF��H2S��H2O | D�� | ���ԣ�KOH��NaOH��Al��OH��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
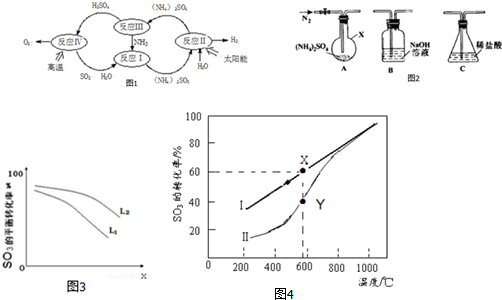
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com