
 | 0 | 2 | 4 | 6 | 8 | 10 |
| c£ØN2O4£© | 0.100 | c1 | 0.050 | c3 | a | b |
| c£ØNO2£© | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
·ÖĪö £Ø1£©ÓɱķæÉÖŖ£¬6minŹ±c£ØNO2£©²»ŌŁ±ä»Æ£¬·“Ó¦“ļµ½Ę½ŗā£¬øł¾Ż·½³ĢŹ½¼ĘĖć”÷c£ØN2O4£©£¬øł¾Ż×Ŗ»ÆĀŹ¼ĘĖćĘ½ŗāŹ±N2O4µÄ×Ŗ»ÆĀŹ£¬6minŗó·“Ó¦“ļĘ½ŗā£¬·“Ó¦»ģŗĻĪļø÷×é·ÖµÄÅØ¶Č²»±ä£»
£Ø2£©ÓÉ”÷c£ØNO2£©£¬øł¾Ż·½³ĢŹ½¼ĘĖć”÷c£ØN2O4£©£¬2minµÄĖÄŃõ»Æ¶žµŖµÄÅضČ=ĘšŹ¼ÅضČ-”÷c£ØN2O4£©£»øł¾Żv=$\frac{”÷c}{”÷t}$¼ĘĖć£»
£Ø3£©øł¾Ż»ÆŃ§Ę½ŗā³£ŹżøÅÄī¼ĘĖć£»
£Ø4£©ŗćĪĀŗćČŻĢõ¼žĻĀ£¬ĒŅ·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ·¢Éś±ä»Æ£¬ĘšŹ¼ĻņČŻĘ÷ÖŠ³äČėµÄŹĒ¶žŃõ»ÆµŖĘųĢ壬ŅŖ“ļµ½ĻąĶ¬µÄĘ½ŗāדĢ¬£¬°“»Æѧ¼ĘĮæŹż×Ŗ»Æµ½N2O4Ņ»±ß£¬Āś×ćN2O4µÄÅضČĪŖ0.1mol/L£®
½ā“š ½ā£ŗ£Ø1£©Ķ¼±źŹż¾Ż·ÖĪöæÉÖŖ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗN2O4?2 NO2£¬
ÓɱķæÉÖŖ£¬6minŹ±·“Ó¦“ļĘ½ŗā£¬c£ØNO2£©=0.120mol/L£¬
N2O4?2NO2£¬
ÅØ¶Č±ä»Æ£ŗ0.06mol/L 0.120mol/L
ĖłŅŌĘ½ŗāŹ±N2O4µÄ×Ŗ»ÆĀŹĪŖ$\frac{0.06mol/L}{0.1mol/L}$=60%£»
4minŹ±Ę½ŗāÓŅŅĘ£¬c2£¾c3£¬60sŹ±c£ØNO2£©²»ŌŁ±ä»Æ£¬·“Ó¦“ļµ½Ę½ŗā£¬a=b£»
¹Ź“š°øĪŖ£ŗ60£»£¾£»=£»
£Ø2£©ÓɱķæÉÖŖ£¬2minŹ±£¬c£ØNO2 £©=0.060mol/L£¬ĖłŅŌ
N2O4?2NO2£¬
ÅØ¶Č±ä»Æ£ŗ0.03mol/L 0.060mol/L
ĖłŅŌ2minµÄĖÄŃõ»Æ¶žµŖµÄÅضČc1=0.1mol/L-0.03mol/L=0.07mol/L£»
ŌŚ0”«2minÄŚĖÄŃõ»Æ¶žµŖµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖv£ØN2O4£©=$\frac{0.03mol/L}{2min}$=0.015mol/£ØL•min£©£»
¹Ź“š°øĪŖ£ŗ0.070£»0.015£»
£Ø3£©N2O4?2NO2£¬
ĘšŹ¼£Ømol/L£© 0.100 0
±ä»Æ£Ømol/L£© 0.060 0.120
Ę½ŗā£Ømol/L£© 0.040 0.120
Ę½ŗā³£Źżk=$\frac{{c}^{2}£ØN{O}_{2}£©}{c£Ø{N}_{2}{O}_{4}£©}$=$\frac{0.1{2}^{2}}{0.04}$=0.36£»
¹Ź“š°øĪŖ£ŗ0.36£»
£Ø4£©ŗćĪĀŗćČŻĢõ¼žĻĀ£¬ĒŅ·“Ó¦Ē°ŗóĘųĢåµÄĪļÖŹµÄĮæ·¢Éś±ä»Æ£¬ĘšŹ¼ĻņČŻĘ÷ÖŠ³äČėµÄŹĒ¶žŃõ»ÆµŖĘųĢ壬ŅŖ“ļµ½ĻąĶ¬µÄĘ½ŗāדĢ¬£¬°“»Æѧ¼ĘĮæŹż×Ŗ»Æµ½N2O4Ņ»±ß£¬Āś×ćN2O4µÄÅضČĪŖ0.100mol/L£¬ÓÉN2O4£Øg£©?2NO2£Øg£©æÉÖŖ£¬¶žŃõ»ÆµŖµÄ³õŹ¼ÅضČ=2”Į0.100mol/L=0.200mol/L£»
¹Ź“š°øĪŖ£ŗ0.200£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·“Ó¦ĖŁĀŹ”¢»ÆŃ§Ę½ŗā³£Źż”¢»ÆŃ§Ę½ŗāµÄÓŠ¹Ų¼ĘĖć”¢µČŠ§Ę½ŗāµČ£¬ÄѶČÖŠµČ£¬×¢Ņā»ł“”ÖŖŹ¶µÄ»żĄŪÕĘĪÕ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| ·“Ó¦Ź±¼ä/min | n£ØCO£©/mol | n£ØH2O£©/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A£® | ·“Ó¦ŌŚt1 minÄŚµÄĘ½¾łĖŁĀŹĪŖv£ØH2£©=$\frac{0.40}{{t}_{1}}$mol/£ØL•min£© | |
| B£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė0.60 mol COŗĶ1.20 mol H2£¬µ½“ļĘ½ŗāŹ±£¬n£ØCO2£©=0.40 mol | |
| C£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĻņĘ½ŗāĢåĻµÖŠŌŁĶØČė0.20 mol CO£¬ÓėŌĘ½ŗāĻą±Č£¬“ļµ½ŠĀĘ½ŗāŹ±CO×Ŗ»ÆĀŹ¼õŠ”£¬H2µÄĢå»ż·ÖŹżŅ²¼õŠ” | |
| D£® | ĪĀ¶ČÉżÖĮ800”ę£¬ÉĻŹö·“Ó¦Ę½ŗā³£ŹżĪŖ0.64£¬ŌņÕż·“Ó¦ĪŖĪüČČ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | COŹĒ»¹Ō¼Į | B£® | Fe2O3±»»¹Ō | ||
| C£® | ŹōÓŚŃõ»Æ»¹Ō·“Ó¦ | D£® | ŹōÓŚÖĆ»»·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 Ļņ½öŗ¬Fe2+£¬I-£¬Br-µÄČÜŅŗÖŠĶØČėŹŹĮæµÄĀČĘų£¬ČÜŅŗÖŠÕāÖÖĄė×ÓµÄĪļÖŹµÄĮæĖęĻūŗÄĀČĘųĪļÖŹµÄĮæµÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©
Ļņ½öŗ¬Fe2+£¬I-£¬Br-µÄČÜŅŗÖŠĶØČėŹŹĮæµÄĀČĘų£¬ČÜŅŗÖŠÕāÖÖĄė×ÓµÄĪļÖŹµÄĮæĖęĻūŗÄĀČĘųĪļÖŹµÄĮæµÄ±ä»ÆČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ£Ø””””£©| A£® | Ļ߶Ī¢ó“ś±ķFe2+µÄ±ä»ÆĒéæö | B£® | Ō»ģŗĻČÜŅŗÖŠn£ØFeBr2£©=4mol | ||
| C£® | Ļ߶Ī¢ń“ś±ķBr-µÄ±ä»ÆĒéæö | D£® | aÖµµČÓŚ6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÖŠŗĶ10 mL 0.1mol•L-1 “×ĖįÓėÖŠŗĶ100 mL 0.01mol•L-1 µÄ“×ĖįĖłŠčĶ¬ÖÖ¼īČÜŅŗµÄÓĆĮæ²»Ķ¬ | |
| B£® | Į½ÖÖ“×ĖįČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č·Ö±šc1ŗĶc2£¬pH·Ö±šĪŖaŗĶa+1£¬Ōņc1=10c2 | |
| C£® | ³£ĪĀĻĀ£¬pH=11µÄNaOHČÜŅŗÓėpH=3µÄ“×ĖįČÜŅŗµČĢå»ż»ģŗĻ£¬µĪČėŹÆČļČÜŅŗ³ŹŗģÉ« | |
| D£® | Ļņ0.1mol/LµÄ°±Ė®ÖŠ¼ÓČėÉŁĮæĮņĖįļ§¹ĢĢ壬ŌņČÜŅŗÖŠ$\frac{c£ØO{H}^{-}£©}{c£ØN{H}_{3}•{H}_{2}O£©}$Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ŅŃÖŖijæÉÄę·“Ó¦ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£ŗA£Øg£©+2B£Øg£©?3C£Øg£©+D£Øs£©”÷H£¾0£¬AµÄ×Ŗ»ÆĀŹÓėŹ±¼ät¹ŲĻµČēĶ¼ĖłŹ¾£¬Ķ¼ÖŠĒśĻßa“ś±ķŅ»¶ØĢõ¼žĻĀøĆ·“Ó¦µÄ¹ż³Ģ£®ČōŹ¹aĒśĻß±äĪŖbĒśĻߣ¬æÉÄܲÉČ”µÄ“ėŹ©ŹĒ£Ø””””£©
ŅŃÖŖijæÉÄę·“Ó¦ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ£ŗA£Øg£©+2B£Øg£©?3C£Øg£©+D£Øs£©”÷H£¾0£¬AµÄ×Ŗ»ÆĀŹÓėŹ±¼ät¹ŲĻµČēĶ¼ĖłŹ¾£¬Ķ¼ÖŠĒśĻßa“ś±ķŅ»¶ØĢõ¼žĻĀøĆ·“Ó¦µÄ¹ż³Ģ£®ČōŹ¹aĒśĻß±äĪŖbĒśĻߣ¬æÉÄܲÉČ”µÄ“ėŹ©ŹĒ£Ø””””£©| A£® | Ōö“óAµÄÅØ¶Č»ņ¼õÉŁCµÄÅØ¶Č | B£® | ĖõŠ”ČŻĘ÷µÄČŻ»ż»ņ¼ÓČė“߻ƼĮ | ||
| C£® | ÉżøßĪĀ¶Č»ņŌö“óŃ¹Ēæ | D£® | ŅĘ×ß²æ·ÖD |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CH3-CHØTCH2 | B£® |  | C£® | CH3-CH3 | D£® |  |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ba£ØOH£©2ÓėNaHSO4 | B£® | Ba£ØOH£©2ÓėH2SO4 | ||
| C£® | ŹÆ»ŅĖ®ŗĶ¶žŃõ»ÆĢ¼ | D£® | Ca£ØHCO3£©2ÓėNaOH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
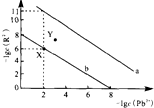 25”ꏱ£¬PbR£ØR2-ĪŖSO42-»ņCO32-£©µÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼£®ŅŃÖŖKsp£ØPbCO3£©£¼Ksp£ØPbSO4£©£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
25”ꏱ£¬PbR£ØR2-ĪŖSO42-»ņCO32-£©µÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼£®ŅŃÖŖKsp£ØPbCO3£©£¼Ksp£ØPbSO4£©£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | ĒśĻßa±ķŹ¾PbCO3 | |
| B£® | ŅŌPbSO4”¢Na2CO3ŗĶ½¹ĢæĪŖŌĮĻæÉÖʱøPb | |
| C£® | µ±PbSO4ŗĶPbCO3³Įµķ¹²“ꏱ£¬ČÜŅŗÖŠ$\frac{c£ØS{O}_{4}^{2-}£©}{c£ØC{O}_{3}^{2-}£©}$=105 | |
| D£® | ĻņXµć¶ŌÓ¦µÄ±„ŗĶČÜŅŗÖŠ¼ÓČėÉŁĮæPb£ØNO3£©2£¬æÉ×Ŗ»ÆĪŖYµć¶ŌÓ¦µÄČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com