
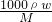 =
=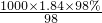 mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.2/L×0.5L,V=0.0054L=5.4mL,
mol/L=18.4mol/L,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.2/L×0.5L,V=0.0054L=5.4mL,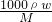 计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算浓硫酸的体积;
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算浓硫酸的体积; 进行误差分析,如果溶质的物质的量偏大或溶液的体积偏小都使配制溶液浓度偏高.
进行误差分析,如果溶质的物质的量偏大或溶液的体积偏小都使配制溶液浓度偏高. 理解配制原理,注意容量瓶规格的选取,为易错点.
理解配制原理,注意容量瓶规格的选取,为易错点. 

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省雅安中学高一(上)月考化学试卷(10月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com