
【题目】某强酸性溶液中可以大量共存的离子组是
A.K+、NO3﹣、OH﹣、Cl﹣
B.SO42﹣、Mg2+、Cl﹣、Na+
C.SO42﹣、Na+、Mg2+、SO32﹣
D.Cl﹣、SCN﹣、K+、Fe3+
科目:高中化学 来源: 题型:
【题目】对于可逆反应H2(g) + I2(g)![]() 2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
2HI(g),在恒温时由H2(g)和I2(g)开始反应,下列说法正确的是
A. H2(g)的消耗速率与HI(g)的生成速率比为2:1
B. 增大压强(通过改变体积实现),混合气体的颜色不变
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,用同种物质表示的正、逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水脱氮工艺中有一种方法是在废水中加入NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中,不正确的是( )
A.反应中氮元素被氧化
B.还原性NH4+>Cl-
C.反应中氯元素被还原
D.经此法处理过的废水可以直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知ɑ1、ɑ2分别为A在甲、乙两个恒容容器中平衡体系A(g) + 2B(g)![]() C(g)、2A(g)
C(g)、2A(g)![]() C(g)中A的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
C(g)中A的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. ɑ1、ɑ2均减小 B. ɑ1、ɑ2均增大 C. ɑ1减小,ɑ2增大 D. ɑ1增大,ɑ2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
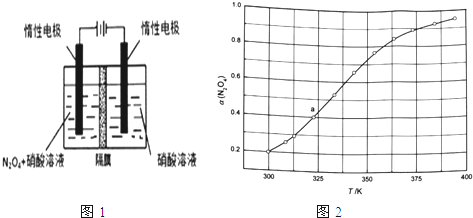
【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为___ .
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H=___ .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0 , 第2.00min时体系压强为p,则p:p0=___ ;1.00~3.00min内,O2的平均反应速率为___ .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由___ ,若要提高N2O4转化率,除改变反应温度外,其他措施有___ (要求写出两条).
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl=___ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___ .

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠及其化合物的说法中正确的是
A.钠的硬度很大,无法用小刀切开B.钠与氧气反应的产物只能是氧化钠
C.金属钠着火时,用细沙覆盖灭火D.工业上通过电解氯化钠溶液制备金属钠和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是几则广告语,请判断在上述广告语中,有多少条在科学性上有明显的错误?
①这种食品由纯天然谷物制成,不含任何糖类,糖尿病患者也可放心大量食用
②这种饮料含有多种无机盐,能有效补充人体运动时消耗的能量
③这种矿泉水含有人体所需的部分大量元素和微量元素
④这种口服液含有丰富的钙、铁、锌、硒等微量元素
A. 1条 B. 2条 C. 3条 D. 4条
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,作为生命活动的体现者、遗传信息的携带者、膜结构基本支架的依次是
A. 糖类,脂类、核酸 B. 蛋白质、核酸、磷脂
C. 蛋白质、糖类、核酸 D. 蛋白质、磷脂、核酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:反应aA(g)+bB(g)cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L1·s1,则该反应的化学方程式为______________。
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L1·s1;乙:v(B)=0.12 mol·L1·s1;丙:v(C)=9.6 mol·L1·min1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为___________(用甲、乙、丙表示)。
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
编号 | 操作 | 实验现象 |
① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入1~2 滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5 ℃左右冷水的烧杯中;将试管B放入盛有40 ℃左右热水的烧杯中 | 试管A中不再产生气泡试管B中产生的气泡量增大 |
② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未见气泡产生 |
(3)实验①的目的是_______________________________,实验中滴加FeCl3溶液的目的是____________________________。
(4)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是______________________________________________________________(用实验中所提供的几种试剂)。

(5)某同学在50 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如右图所示,则A、B、C三点所表示的即时反应速率最慢的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com