
下列实验操作能够达到实验目的的是( )。

A.用激光笔鉴别淀粉溶液和蔗糖溶液
B.实验室采用上图所示装置收集SO2
C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
D.配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.1元素周期表练习卷(解析版) 题型:填空题
A、B、C为短周期元素,在周期表中所处的位置如图所示。
A |
| C |
| B |
|
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称________、________。
(2)B位于元素周期表中第________周期第________族。
(3)C的原子结构示意图为________。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。

下列叙述错误的是( )。
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:填空题
吡洛芬是一种用于治疗风湿病的药物。它的合成路线如下:


回答下列问题:
(1)B→C的反应类型为_____________________________。
(2)A→B反应的化学方程式为______________________________________
__________________________________。
从整个合成路线看,步骤A→B的目的是_______________________________。
(3)E的结构简式为____________________________。
(4)A在一定条件下可生成
F( )。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。
)。写出同时满足下列条件的F的两种同分异构体的结构简式_____________________________。
①属于芳香族化合物;②是一种α?氨基酸;③分子中有6种不同化学环境的氢。
(5)非那西汀是一种解热药,其结构简式为 ,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下:
,写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用) 。合成路线流程图示例如下:

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练1练习卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
( )。

A.Y元素最高价氧化物对应的水化物化学式为H3YO4
B.Y最简单气态氢化物的水溶液显弱碱性
C.原子半径由小到大的顺序为:X<Z<Y<W
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:填空题
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为________mol。
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第9讲非金属元素及其化合物练习卷(解析版) 题型:选择题
下列化学实验事实及其结论都正确的是( )。
选项实验事实结论
A将SO2通入含HClO的溶液中生成H2SO4HClO酸性比H2SO4强
B铝箔在酒精灯火焰上加热熔化但不滴落铝箔表面氧化铝熔点高于铝
CSiO2可以与NaOH溶液及HF溶液反应SiO2属于两性氧化物
D将SO2通入溴水中,溴水褪色SO2具有漂白性
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第7讲水溶液中的离子平衡练习卷(解析版) 题型:填空题
已知25 ℃时弱电解质的电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图所示。

反应开始时,两种溶液产生CO2的速率明显不同的原因是________;反应结束后所得溶液中c(SCN-)________c(CH3COO-)(填“>”、“=”或<)。
(2)2.0×10-3 mol·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF电离平衡常数为Ka(HF)=________(列式求值)。
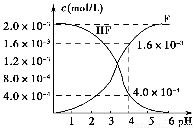
(3)难溶物质CaF2溶度积常数为Ksp=1.5×10-10,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1的CaCl2溶液等体积混合,调节溶液pH=4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?________(填“有”或“没有”),简述理由:____________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第4讲物质结构元素周期律练习卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )。

A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.最简单气态氢化物的热稳定性:Z>W
D.X与氢元素组成的化合物XH5与水反应可产生两种气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com