
| A、②③④ | B、①②③ |
| C、①③ | D、①② |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H2O2是氧化剂,H2O2中的氧元素被还原 |
| B、每生成1mol O2转移的电子的物质的量为4mol |
| C、ClO2中的氯元素被氧化 |
| D、ClO2是氧化剂,H2O2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
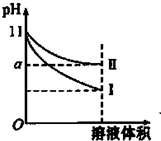 某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( )
某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( )| A、a的数值一定大于9 |
| B、I为氢氧化钠溶液稀释时溶液的pH变化曲线 |
| C、完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水) |
| D、稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | ||||
| B、醋酸溶液与新制氢氧化铜反应:CH3COOH+OH-→CH3COO-+H2O | ||||
C、苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O
| ||||
D、乙醛溶液与足量的银氨溶液共热 CH3CHO+2[Ag(NH3)2]++2OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铵溶液可用于除铁锈 |
| B、明矾可用于净水 |
| C、热的纯碱溶液可用于去除油污 |
| D、饱和硫酸钠溶液可使蛋白质盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、加入氨水至pH=7,c(NH4+)>c(C1-) |
| C、滴加浓盐酸可能有,c(NH4+)=c(H+) |
| D、加入少量CH3COONa固体,c(NH4+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
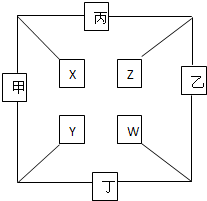 甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知:
甲、乙、丙、丁四种单质在点燃条件下两两化合生成X、Y、Z、W四种化合物,转化关系如图所示.又知:查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平均总压强/KPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平均气体总浓度/10-3mol?L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com