
【题目】表示金属冶炼原理的主要化学反应中,不可能有
A. 氧化还原反应 B. 置换反应 C. 分解反应 D. 复分解反应
【答案】D
【解析】金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程。金属的活动性不同,可以采用不同的冶炼方法。总的说来,金属的性质越稳定,越容易将其从化合物中还原出来。故A可能。
金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来,例如:2HgO ![]() 2Hg+O2↑,属于分解反应,也是氧化还原反应;
2Hg+O2↑,属于分解反应,也是氧化还原反应;
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,例如:Fe2O3+3CO ![]() 2Fe+CO2↑,属于氧化还原反应;
2Fe+CO2↑,属于氧化还原反应;
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,例如:2Al2O3 ![]() 4Al+3O2↑,属于分解反应,也是氧化还原反应;
4Al+3O2↑,属于分解反应,也是氧化还原反应;
置换法:活泼金属把较不活泼金属从其盐中置换出来,例如:Fe+CuSO4=Cu+FeSO4,属于置换反应,也是氧化还原反应。
以上分析可知,B、C也有可能,故选D.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】苹果汁是人们喜爱饮料,由于此饮料中含有Fe2+ , 现榨的苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入维生素C,可有效防止这种现象发生.这说明维生素C具有( )
A.氧化性
B.还原性
C.碱性
D.酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
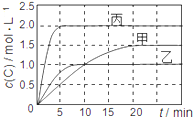
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度 | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是 ( )
A. 由图可知:T1<T2,且该反应为吸热反应
B. T1时该反应的平衡常数K=7.2
C. 前10min甲、乙、丙三个容器中A的平均反应速率:v(A)乙<v(A)甲<v(A)丙
D. 平衡时A的质量m:m乙<m甲<m丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比8:1:2,则溶液中Na2SO4、NaCl、NaOH个数比为
A.1:1:1 B.1:4:2 C.1:2:4 D.1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)![]() x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
![]()
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
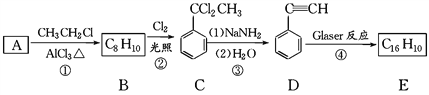
回答下列问题:
(1)B的结构简式为_______________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)反应④ 化学反应方程式为______________________。
(4)下列说法不正确的是(____)
A.用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气4mol;
B.E分子中处于同一条直线上的原子最多有8个;
C.C分子的核磁共振氢谱面积比为1:2:2:3
D.可用酸性高锰酸钾溶液鉴别A和B
(5)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:_______________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为:_______________________。
(6)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为 3∶1,符合该条件的同分异构体有_______种。
(7)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢元素有三种核素:1H、2H、3H,氯元素有两种核素:35Cl、37Cl;最多可以组成的氯化氢分子的种类有
A. 5种 B. 6种 C. 7种 D. 8种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com