
下列有关氧化还原反应的说法正确的是
A.2Na2O2+2H2O=4NaOH+O2? 反应中,Na2O2是氧化剂,H2O是还原剂
B.KClO3+6HCl=KCl+3Cl2?+3H2O 反应中,被氧化的氯元素与被还原的氯元素质量比为6:1
C.KClO3+6HCl=KCl+3Cl2?+3H2O 反应中,转移的电子数为6e-
D.CaH2+2H2O=Ca(OH)2+2H2? 反应中,Ca(OH)2既不是氧化产物也不是还原产物
科目:高中化学 来源:2014秋贵州省遵义市高二上学期期中化学(文)试卷(解析版) 题型:选择题
鉴别织物成分是真蚕丝还是“人造丝”,在如下①-④的各方法中正确的是
①滴加浓硝酸 ②滴加浓硫酸 ③滴加酒精 ④灼烧
A.①和③ B.③和④ C.①和④ D.①和②
查看答案和解析>>
科目:高中化学 来源:2014秋福建省高二上学期期中化学(文)试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列物质所含分子数最少的是
A.标准状况下4.48L氧气
B.11g二氧化碳气体(CO2的摩尔质量是44g·mol-1)
C.0.5mol氨气
D.含NA个氢分子的氢气
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
向浓度为0.1 mol·L-1的K2CO3溶液中分别加入下列物质,能使C(CO32-)增大的是
A.H2O B.CO2 C.KHSO4固体 D.KOH固体
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:实验题
(13分)表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法。请完成下列填空题。
(1)用10%(密度为1.00g·cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液。
①计算:需______g10%(密度为1.00g·cm-3)的NaOH溶液,需加______mL水(密度为1.00g·cm-3)进行稀释。
②量取:用_______mL量筒(可供选择的量筒规格有:5mL、10mL、25mL、50mL,下同)量取10%的NaOH溶液,量取时视线要跟量筒内液体_______相切,然后倒入烧杯里,用______mL量筒量取蒸馏水注入烧杯里。
(2)把98%(密度为1.84g·cm-3)的浓硫酸稀释成3 mol/L的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸___________mL(保留一位小数)。
②配制操作可分解成如下几步,正确的操作顺序是:___________。
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线
③如果上述C操作中把未冷却的稀硫酸注入容量瓶中,所配溶液的浓度将_________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中量取浓硫酸后量筒内滞留的浓硫酸用少量蒸馏水洗涤并将洗涤液转入E操作中的小烧杯中,所配溶液的浓度将_________;如果上述G操作中目光仰视,所配溶液的浓度将_________;如果上述D操作中目光俯视,所配溶液的浓度将_________。
(3)实验室用NaOH固体配制1mol/L的NaOH溶液和用98%(密度为1.84g·cm-3)的浓硫酸配制1mol/L的H2SO4溶液各100mL。
①配制1mol/L的NaOH溶液,在用托盘天平称取NaOH固体时,天平读数为_______(填代号,下同)。
A.4.0g B.小于4.0g C.大于4.0g
②配制1mol/L的 H2SO4溶液,在烧杯中稀释浓硫酸的正确操作是: 。
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
下列离子方程式改写成化学方程式正确的是
A.Cu2++2OH-=Cu(OH)2? ,CuCO3+2NaOH Cu(OH)2?+Na2CO3
Cu(OH)2?+Na2CO3
B.Zn+2H+=H2?+Zn2+ ,Zn+2HNO3 H2?+Zn(NO3)2
H2?+Zn(NO3)2
C.Ca2++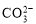 =CaCO3? , Ca(NO3)2+Na2CO3
=CaCO3? , Ca(NO3)2+Na2CO3 CaCO3 ?+NaNO3
CaCO3 ?+NaNO3
D.H++OH-=H2O , 2KOH+H2SO4 K2SO4+2H2O
K2SO4+2H2O
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
下列变化必须另加入还原剂才能实现的是
A.MnO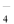 →MnO2 B.ClO3-→Cl-
→MnO2 B.ClO3-→Cl-
C.MnO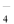 →Mn2+ D.FeO→Fe3O4
→Mn2+ D.FeO→Fe3O4
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
如图1所示,U形管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U形管内会形成三色“彩虹”的现象,它从左到右颜色的次序是:
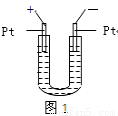
A.蓝、紫、红 B.红、蓝、紫
C.红、紫、蓝 D.蓝、红、紫
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:填空题
(12分)在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4)/mol·L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:
c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com