
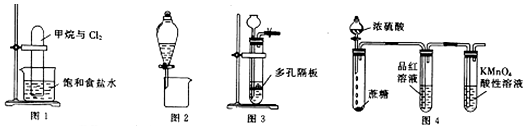
| A. | 图1可实现甲烷与氯气在光照条件下的置换反应 | |
| B. | 图2可分离CH3CH3OH和CH3COOC2H5的混合液 | |
| C. | 图3可用于锌粒与稀硝酸反应制备氢气 | |
| D. | 图4可说明浓H2SO4具有脱水性和强氧化性,SO2具有漂白性和还原性 |
分析 A.光照下甲烷与氯气发生取代反应;
B.CH3CH3OH和CH3COOC2H5的混合液互溶、不分层;
C.锌粒与稀硝酸发生氧化还原反应不生成氢气;
D.浓硫酸具有脱水性,使蔗糖碳化后,C与浓硫酸反应生成二氧化硫,品红、高锰酸钾均褪色.
解答 解:A.光照下甲烷与氯气发生取代反应,则图中装置可实现甲烷与氯气在光照条件下的取代反应生成氯代烃和HCl,故A错误;
B.CH3CH3OH和CH3COOC2H5的混合液互溶、不分层,不能利用图中分液漏斗分离,故B错误;
C.锌粒与稀硝酸发生氧化还原反应不生成氢气,应选Zn与稀硫酸反应,故C错误;
D.浓硫酸具有脱水性,使蔗糖碳化后,C与浓硫酸发生氧化还原反应生成二氧化硫,体现浓硫酸的强氧化性,图中品红、高锰酸钾均褪色,品红褪色与二氧化硫的漂白性有关,高锰酸钾褪色与二氧化硫的还原性有关,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、物质的性质、混合物分离提纯、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
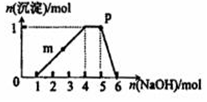 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子.向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如右图所示.下列有关判断正确的是( )| A. | m点处反应:H++OH-═H2O | |
| B. | p点:c(NH4+)>c(OH-)>c(H+) | |
| C. | 若取原溶液做焰色反应实验,焰色应为黄色 | |
| D. | 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| B. | 铜丝插入Fe2(SO4)3溶液中:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向FeBr2溶液中通入过量Cl2:2Br-+Cl2═Br2+2Cl- | |
| D. | 向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O═H2SiO3+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与醋酸反应:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaHCO3溶液显碱性:HCO3-+H2O═CO32-+H3O+ | |
| D. | 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号1 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液呈碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 化合物WY2不溶于水 | |
| B. | 原子半径:W>X>Y | |
| C. | 最高价氧化物对应水化物的酸性:W<Z | |
| D. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
周期 族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
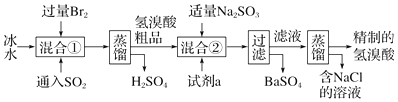
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用植物油的氧化反应可获得人造脂肪 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 工业生产玻璃、水泥和陶瓷,均需用石灰石作原料 | |
| D. | 明矾和“84”消毒液均可用于自来水的杀菌消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com