



科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
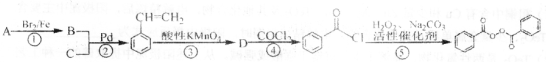
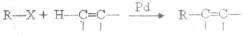
 ),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;
),在一定条件下能发生银镜反应,且1molE最多可得到4molAg;查看答案和解析>>
科目:高中化学 来源: 题型:
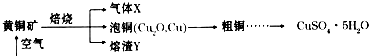
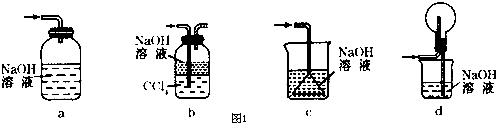
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol |
| B、0.4 mol |
| C、0.6mol |
| D、2.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
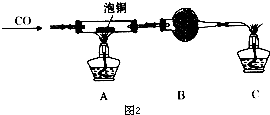
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离常数(25℃) |
| HCN | K=5.0×10-10 |
| H2CO3 | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A、等浓度等体积的NaCN、NaHCO3溶液混合:c(Na+)+c(H+)=c(HCO3-)+c(CN-)+c(OH-)+2c(CO32-) | ||
B、若NaCN的水解平衡常数为:Kh=
| ||
| C、等浓度等体积的NaCN和NaCl溶液中离子数目前者大于后者 | ||
| D、过量CO2通入NaCN溶液中:CO2+H2O+CN-=HCO3-+HCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com