
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.被氧化和被还原的离子数目比为![]()
B.该反应说明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 发生氧化反应,转移
发生氧化反应,转移![]()
D.若利用该反应设计原电池,则负极反应为:![]()
【答案】C
【解析】
由题意可以确定,铁元素的化合价升高,N元素的化合价格下降低,则有8Fe2++NO3-+10H+=8Fe3++NH4++3H2O,该反应中氧化剂(NO3-)与还原剂(Fe2+)物质的量之比为1:8; 若有lmol NO3- 发生还原反应,转移电子数为8mol;若把该反应设计成原电池,负极反应为Fe2+-e-=Fe3+,据此分析。
A.反应中氧化剂![]() 与还原剂
与还原剂![]() 物质的量之比为1:8,故A正确;
物质的量之比为1:8,故A正确;
B.酸性条件下![]() 可氧化
可氧化![]() ,说明
,说明![]() 、
、![]() 、
、![]() 在溶液不能大量共存,故B正确;
在溶液不能大量共存,故B正确;
C.若有![]() 发生还原反应,转移电子数为8mol,而不是氧化,故C错误;
发生还原反应,转移电子数为8mol,而不是氧化,故C错误;
D.若把该反应设计成原电池,负极发生氧化反应,电极反应为![]() ,故D正确。
,故D正确。
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学用语表达正确的是( )
A | 质子交换膜氢氧燃料电池的负极反应 | O2+2H2O+4e﹣=4OH﹣ |
B | 用铁电极电解饱和食盐水 | 2Cl﹣+2H2O=Cl2↑+H2↑+20H﹣ |
C | 锅炉水垢中的CaSO4用饱和Na3CO3溶液浸泡 | CO32﹣+CaSO4=CaCO3+SO42﹣ |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO43﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料在疫情防控和治疗中起到了重要的作用。下列说法正确的是
A.聚乙烯是生产隔离衣的主要材料,能使酸性高锰酸钾溶液褪色
B.聚丙烯酸树脂是3D打印护目镜镜框材料的成分之一,可以与NaOH溶液反应
C.天然橡胶是制作医用无菌橡胶手套的原料,它是异戊二烯发生缩聚反应的产物
D.聚乙二醇可用于制备治疗新冠病毒的药物,聚乙二醇的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图1所示。
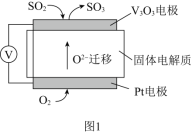
①固体电解质中O2-向______极移动(填“正”或“负”)。
②写出V2O5电极的电极反应式:_____________。
(2)近期科学家研究发现微生物可将生产废水中的尿素[CO(NH2)2]直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
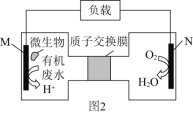
①N极为____极(填“正”或“负”),M电极反应式______________________。
②N极消耗标准状况下33.6L气体时,M极理论上处理的尿素的质量为______g。
(3)人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是__________。
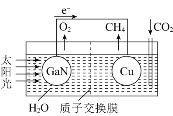
A.该装置为原电池,且铜为正极
B.电池工作时,H+向Cu电极移动
C.GaN电极表面的电极反应式为2H2O-4e-=O2+4H+
D.反应CO2+2H2O![]() CH4+2O2中每消耗1molCO2转移4mole-
CH4+2O2中每消耗1molCO2转移4mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物燃料电池进行废水处理,可实现碳氮联合转化。某微生物燃料电池的工作原理如图所示,其中M、N为厌氧微生物电极。下列有关叙述错误的是

A.负极反应式为![]()
B.电池工作时,![]() 由M极区移向N极区
由M极区移向N极区
C.相同条件下,M极区生成的![]() 与N极区生成的
与N极区生成的![]() 的体积之比为
的体积之比为![]()
D.好氧微生物反应器中发生的反应的离子方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如下图所示。下列说法正确的是( )

A. 电流由左侧电极经过负载后流向右侧电极
B. 放电过程中,正极附近pH 变小
C. 若1molO2 参与电极反应,有4 mol H+穿过质子交换膜进入右室
D. 负极电极反应为:H2PCA + 2e-=PCA + 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
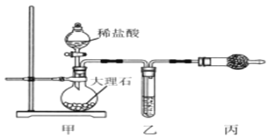
①丙装置的名称是__________,乙、丙装置中盛装的试剂分别是______、_____。
②若CO2 中混有HCl,则HCl与Na2O2反应的化学方程式为________。
(2)按照下面的装置图进行实验(夹持装置略)。
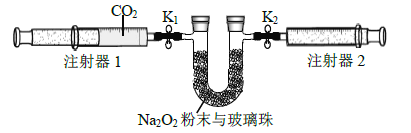
①先组装仪器,然后_____________,再用注射器1抽取100 mL 纯净的CO2,将其连接在K1 处,注射器2的活塞推到底后连接在K2 处,具支U 形管中装入足量的Na2O2 粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是__________。
③实验过程中反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9C)与Cl2 反应制备SnCl4装置如下图所示。
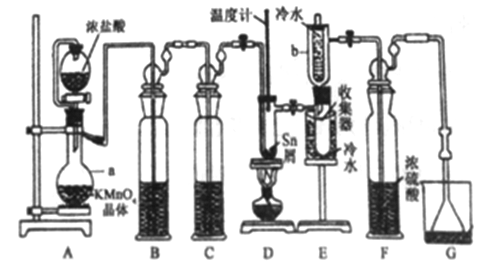
已知,① SnCl4在空气中极易水解生成SnO2xH2O;②SnCl2、SnCl4有关物理性质如下表。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器a的名称是__________,其中发生反应的离子方程式为________。
(2)装置B、C 中盛装的试剂分别是_______、__________。
(3)当观察到装置F液面上方出现_____现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有:①加快氯气与锡反应,②__________。
(4)E装置中b的作用是___________。
(5)若制得产品中含有少量Cl2,则可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(6)可用滴定法测定最后产品的纯度。准确称取该样品mg加入到适量浓盐酸溶解,然后再加水稀释至250 mL,用移液管移取25.00 ml,稀释后的溶液于锥形瓶中,加入两滴淀粉溶液作指示制,用cmol/L 的KIO3 标准溶液进行滴定,平行滴定3 次,平均消耗V mL的标准溶液。已知滴定时发生的反应为:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列问题:
①判断达到滴定终点的现象为____________。
②产品中SnCl2(摩尔质量为M g/mol )的含量为____%(用含m、c、V、M 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com